一、实验目的
1.掌握电位滴定法测量离子浓度的一般原理;
2.学会用电位滴定法测定难溶盐的溶度积常数。
二、方法原理
当银丝电极插入含有Ag+的溶液时,其电极反应的能斯特响应可表示为:
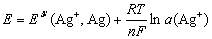
如果与一参比电极组成电池可表示为:
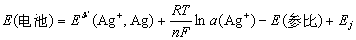
进一步简化为:
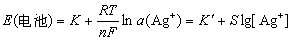
式中包括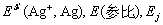 和r(Ag+)常数项。银电极不仅可指示溶液中Ag+的浓度变化,而且也能指示与Ag+反应的阴离子的浓度变化。例如,卤素离子。
和r(Ag+)常数项。银电极不仅可指示溶液中Ag+的浓度变化,而且也能指示与Ag+反应的阴离子的浓度变化。例如,卤素离子。
本实验利用卤素阴离子(I-、Cl-)与银离子生成沉淀的溶度积Ksp非常小,在化学计量点附近发生电位突跃,从而通过测量电池电动势的变化来确定滴定终点。在终点时:
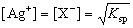
其中X-为Cl-、I-,代入终点时的滴定电池方程:
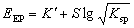
用该式即可计算出被滴定物质难溶盐的Ksp。而式中 和S值可利用第二终点之后过量的[Ag+]与E(电池)关系作图求得,由直线的截距确定
和S值可利用第二终点之后过量的[Ag+]与E(电池)关系作图求得,由直线的截距确定 ,斜率确定S。
,斜率确定S。
通常的电位滴定使用甘汞或AgCl/Ag参比电极,由于它们的盐桥中含有氯离子会渗漏于溶液中,不适合在这个实验中使用,故可选用甘汞双液接硝酸盐盐桥,或硫酸亚汞电极。
三、仪器设备与试剂材料
1.pH/mV计,电磁搅拌器。
2.银电极,双液接饱和甘汞电极。
3.硝酸银标准溶液,0.100mol∙L-1:溶解8.5g AgNO3于500mL去离子水中,将溶液转入棕色试剂瓶中置暗处保存。准确称取1.461g基准NaCl,置于小烧杯中,用去离子水溶解后转入250mL容量瓶中,加水稀释至刻度,摇匀。准确移取25.00mL NaCl标准溶液于锥形瓶中,加25mL水,加1mL15% K2CrO4,在不断摇动下,用AgNO3溶液滴定至呈现砖红色即为终点。根据NaCl标准溶液浓度和滴定中所消耗的AgNO3体积(mL),计算AgNO3的浓度。
4.Ba(NO3)2(固体)。
5.硝酸,6mol∙L-1。
6.试样溶液(其中含Cl-和I-分别都为0.05mol∙L-1左右)。
四、实验步骤
1.按图示安装仪器。


2.用移液管取20.00mL的Cl-、I-混合试样溶液于100mL烧杯中,再加约30mL水,加几滴6mol∙L-1硝酸和约0.5g Ba(NO3)2固体。将此烧杯放在磁力搅拌器上,放入搅拌磁子,然后将清洗后的银电极和参比电极插入溶液。滴定管应装在烧杯上方适当位置,便于滴定操作。
3.开动搅拌器,溶液应稳定而缓慢地转动。开始每次加入滴定剂1.0mL,待电位稳定后,读取其值和相应滴定剂体积记录在表格里。随着电位差的增大,减少每次加入滴定剂的量。当电位差值变化迅速,即接近滴定终点时,每次加入0.1mL滴定剂。第一终点过后,电位读数变化变缓,就增大每次加入滴定剂量,接近第二终点时,按前述操作进行。
4.重复测定两次。每次的电极、烧杯及搅拌磁子都要清洗干净。
五、数据处理
1.按下表格式记录和处理数据:
|
滴入AgNO3
V/mL
|
电位
E/mV
|
△E
/mV
|
△V
/mL
|
△E/△V
/(mV/mL)
|
平均体积
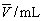
|
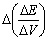
|
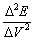
|
|

|
|
|
|
|
|
|
|
2.作E~V,△E/△V~V,△2E/△V2~V滴定曲线。
3.求算试样溶液中Cl-和I-的质量浓度(mg∙L-1)。
4.从实验数据计算AgI和AgCl的Ksp。
六、问题讨论
1.在滴定试液中加入Ba(NO3)2的目的是什么?
2.如果试液中Cl-和I-的浓度相同,当AgCl开始沉淀时,AgI还有百分之几没有沉淀?
3.如果有1.0mol∙L-1氨与Cl-和I-的共存在滴定试液中,将会对上述滴定产生什么样的影响?