一、实验目的
1.掌握用循环伏安法判断电极过程的可逆性;
2.学会使用循环伏安仪;
3.测量峰电流和峰电位。
二、方法原理
循环伏安法与单扫描极谱法相似。在电极上施加线性扫描电压,当到达某设定的终止电压后,再反向回扫至某设定的起始电压,若溶液中存在氧化态O,电极上将发生还原反应:
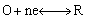
反向回扫时,电极上生成的还原态R将发生氧化反应:
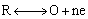
峰电流可表示为:
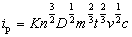
其峰电流与被测物质浓度c、扫描速度v等因素有关。
从循环伏安图可确定氧化峰峰电流ipa和还原峰电流ipc,氧化峰峰电位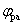 值和还原峰峰电位 值和还原峰峰电位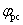 值。 值。
对于可逆体系,氧化峰峰电流与还原峰峰电流比:
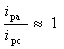
氧化峰峰电位与还原峰峰电位差:
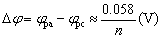
条件电位 : :

由此可判断电极过程的可逆性。
三、仪器设备与试剂材料
1.仪器:循环伏安仪;x-y函数记录仪;金圆盘电极、铂圆盘电极或玻璃碳电极,铂丝电极和饱和甘汞电极。
2.试剂:1.00×10-2mol∙L-1 K3Fe(CN)6;1.0mol∙L-1 KNO3。
四、实验步骤
1.金圆盘电极(或铂圆盘电极、玻璃碳电极)的预处理
用Al2O3粉(或牙膏)将电极表面抛光(或用抛光机处理),然后用蒸馏水清洗,待用。也可用超声波处理。
2.K3Fe(CN)6溶液的循环伏安图
在电解池中放入1.00×10-3mol∙L-1
K3Fe(CN)6 + 0.50mol∙L-1 KNO3溶液,插入铂圆盘(或金圆盘)指示电极、铂丝辅助电极和饱和甘汞电极,通N2除O2。
以扫描速率20mV∙s-1,从+0.80~-0.20V扫描,记录循环伏安图。
以不同扫描速率10、40、60、80、100和200mV∙s-1,分别记录从+0.80~-0.20V扫描的循环伏安图。
3.不同浓度的K3Fe(CN)6溶液的循环伏安图
以扫描速率20mV∙s-1,从+0.80~-0.20V扫描,分别记录1.00×10-5mol∙L-1 K3Fe(CN)6、1.00×10-4 mol∙L-1 K3Fe(CN)6、1.00×10-3 mol∙L-1 K3Fe(CN)6、1.00×10-2 mol∙L-1 K3Fe(CN)6 +
0.50 mol∙L-1 KNO3溶液的循环伏安图。
五、数据处理
1.从K3Fe(CN)6溶液的循环伏安图测定ipa、ipc和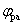 、 、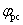 值。 值。
2.分别以ipc和ipa对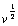 作图,说明峰电流与扫描速率间的关系。 作图,说明峰电流与扫描速率间的关系。
3.计算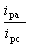 值、 值、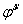 值和 值和 值。 值。
4.从实验结果说明K3Fe(CN)6在KNO3溶液中极谱电极过程的可逆性。
六、注意事项
1.指示电极表面必须仔细清洗,否则严重影响循环伏安图图形。
2.每次扫描之间,为使电极表面恢复初始条件,应将电极提起后再放入溶液中或用搅拌子搅拌溶液,等溶液静止1~2min再扫描。
七、问题讨论
1.解释K3Fe(CN)6溶液的循环伏安图形状。
2.如何用循环伏安法来判断极谱电极过程的可逆性。
3.若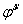 值和 值和 值的实验结果与文献值有差异,试说明其原因。 值的实验结果与文献值有差异,试说明其原因。
|