|
一、实验目的
试验并了解:
(1)铜、银、锌、汞的氢氧化物的形成和性质。
(2)铜、银、锌、汞氨配合物的形成和性质。
(3)铜、银、锌、汞的硫化物的形成和性质。
(4)铜、银、锌、汞的氧化还原性。
(5)铜、银、锌、汞离子的鉴定方法。
二、实验原理
铜、银是周期系IB族元素,价电子层结构为(n-1)d10ns1,在化合物中,铜的氧化数通常是+2,但也有+1,银的氧化数通常是+1。锌、汞是周期系IIB族元素,价电子层结构为(n-1)d10ns2,在化合物中,锌的氧化数一般为+2,汞的氧化数除了+2外,也有+1。铜、银、锌、汞的氢氧化物酸碱性及其脱水性列于表23-1。
表23-1
|
氢氧化物 |
颜色 |
酸碱性 |
脱水性(对热稳定性) |
氧化物颜色 |
|
Cu(OH)2 |
蓝 |
两性偏碱性 |
受热脱水 |
CuO(黑)
|
|
AgOH |
白 |
碱性 |
常温脱水 |
Ag2O(棕) |
|
Hg(OH)2 |
/ |
/ |
极易脱水 |
HgO(黄)
|
|
Zn(OH)2 |
白 |
两性 |
较稳定(高温脱水) |
ZnO(白)
|
Cu2+、Ag+、Zn2+、Hg2+易形成配合物,与氨水的反应物于表23-2。
表23-2
|
|
Cu2+ |
Ag+ |
Zn2+ |
HgCl2 |
|
氨水(适量) |
Cu2(OH)2SO4(蓝色) |
Ag2O(棕) |
Zn(OH)2(白) |
NH2HgCl(s) |
|
氨水(过量) |
[Cu(NH3)4]2+ |
[Ag(NH3)2]+ |
[Zn(NH3)4]2+ |
NH4HgCl(s) |
|
颜色 |
深蓝色 |
无色 |
无色 |
白色沉淀 |
注:HgCl2只有在大量NH4Cl存在下,才能与氨水形成[Hg(NH3)4]2+配离子。如只有氨水存在,则只能形成氨基氯化汞沉淀,而不形成氨配离子。
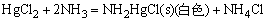
Cu2+、Ag+、Zn2+、Hg2+离子与H2S作用成难溶的并具有不同颜色的硫化物:CuS(黑)、Ag2S(黑)、ZnS(白)、HgS(黑)。由于硫化物的溶解度不同,它们可溶于不同的酸。
ZnS溶解度较小,当用稀HCl(非氧化性酸)溶解时,生成H2S,使溶液中S2-离子浓度降低,致使溶液中c(Zn2+)·c(S2-)<Ksp(ZnS)而使ZnS溶解。
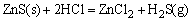
CuS、AgS等这一类溶解度更小的硫化物,如单独用HCl溶解,则溶解0.1mol·dm-3
CuS所需c(H+)高达106mol·dm-3,因此,是不可能溶于HCl的,但可用稀硝酸溶解。HNO3是一种氧化性酸(氧化剂),它将溶液中S2-离子氧化为游离的S,使溶液中S2-离子浓度大大降低,从而使c(Cu2+)·c(S2-)<Ksp(CuS)、c2(Ag+)·c(S2-)<Ksp(Ag2S)而使CuS、Ag2S溶解。
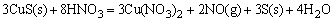
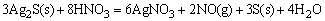
HgS是比CuS、Ag2S更难溶的硫化物,单独用HNO3氧化S2-离子时,还不能使HgS溶解,如改用王水作溶剂,王水可使S2-离子氧化为固体S,同时王水中存在大量Cl-离子又可以与Hg2+离子结合成[HgCl4]2-配离子,这样使c(S2-)和c(Hg2+)同时降低,导致溶液中c(Hg2+)·c(S2-)<Ksp(HgS),而使HgS溶解。
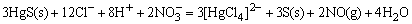
HgS是具有酸性的硫化物。当Hg2+与Na2S作用,最初生成HgS沉淀,沉淀又溶于过量Na2S形成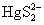 (硫汞酸根)。人们常利用HgS具有酸性这一性质与一些碱性硫化物CuS、PbS、Ag2S等进行分离。 (硫汞酸根)。人们常利用HgS具有酸性这一性质与一些碱性硫化物CuS、PbS、Ag2S等进行分离。
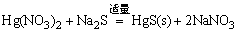
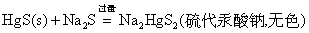
硫代酸盐不稳定,遇酸分解,重新析出HgS沉淀。
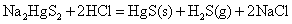
Cu2+、Ag+、Hg2+都具有氧化性。在水溶液中,Cu2+离子的氧化性不是很强的,如从下列电对的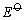 值来看,Cu2+似乎很难得I-离子氧化I2。 值来看,Cu2+似乎很难得I-离子氧化I2。
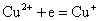
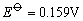
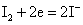
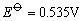
但实际上却能发生下列反应:
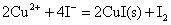
这是由于Cu+与I-离子反应生成难溶于水的CuI沉淀,使溶液中Cu+离子的浓度变为很小,相对来说Cu2+离子的氧化性增强了,即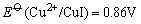 大于 大于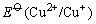 ,当然也大于 ,当然也大于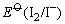 ,因此Cu2+离子可以把I-离子氧化。 ,因此Cu2+离子可以把I-离子氧化。
另外从铜的电势图可以看出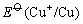 > >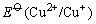
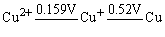
Cu+离子在溶液中能歧化为Cu2+和Cu。又从下列反应式看:
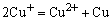
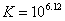
Cu+离子歧化反应的K值较大,同样说明Cu+离子在水溶液中不稳定,但当Cu+离子形成配合物后,它能较稳定地存在于溶液中,例如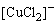 配离子就不易歧化为Cu2+和Cu,这可从其相应的电势图看出: 配离子就不易歧化为Cu2+和Cu,这可从其相应的电势图看出:
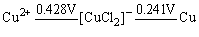
所以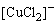 在溶液中是较稳定的。因此在实验中常利用CuSO4或CuCl2溶液与浓HCl和Cu屑混合,在加热的情况下,制定 在溶液中是较稳定的。因此在实验中常利用CuSO4或CuCl2溶液与浓HCl和Cu屑混合,在加热的情况下,制定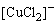 配离子溶液。 配离子溶液。
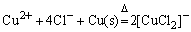
或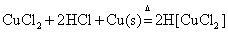
将制得的溶液倒入大量水中稀释,会有白色氯化亚铜CuCl沉淀析出。
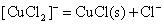
CuCl沉淀也不易歧化为Cu2+和Cu,这同样可由下列电势图得知:
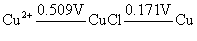
Hg+离子能与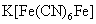 反应生成红棕色 反应生成红棕色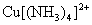 沉淀,这个反应可用来鉴定Cu2+离子。但Fe3+离子的存在有干扰,因为生成蓝色 沉淀,这个反应可用来鉴定Cu2+离子。但Fe3+离子的存在有干扰,因为生成蓝色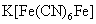 沉淀。为消除干扰,可先加入氨水和NH4Cl溶液,使Fe3+生成Fe(OH)3沉淀,而Cu2+则与氨水形成可溶性 沉淀。为消除干扰,可先加入氨水和NH4Cl溶液,使Fe3+生成Fe(OH)3沉淀,而Cu2+则与氨水形成可溶性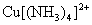 配离子留在溶液中。 配离子留在溶液中。
Ag+离子可利用其能生成难溶性卤化物及形成氨配离子性质来确定Ag+离子的存在(见P52)。
Zn2+离子与二苯硫腙反应生成粉红色螯合物,可用于鉴定Zn2+。
三、仪器与药品
1.仪器:
常用普化实验仪器
2.药品:
H2SO4(1mol·dm-3)
NaOH(2 mol·dm-3、6 mol·dm-3)
HNO3(6 mol·dm-3)
HCl(2 mol·dm-3、6 mol·dm-3、12 mol·dm-3)
CuSO4(0.1 mol·dm-3)
氨水(2 mol·dm-3、6 mol·dm-3)
AgNO3(0.1 mol·dm-3)
KI(0.1 mol·dm-3)
Hg(NO3)2(0.1 mol·dm-3)
NaS2O3(0.1 mol·dm-3)
Zn(NO3)2(0.1 mol·dm-3)
SnCl2(0.1 mol·dm-3)
HgCl2(0.1 mol·dm-3)
K4[Fe(CN)6](0.1 mol·dm-3)
Na2S(0.5 mol·dm-3)
CuCl2(1 mol·dm-3)
王水
H2S饱和溶液
二苯硫腙溶液(将1-2mg二苯硫腙溶于100cm3 CCl4溶液中,溶液为绿色)。
四、实验内容
1.铜、银、锌、汞氢氧化物的制备和性质
(1)用0.1
mol·dm-3 CuSO4溶液制备Cu(OH)2,观察沉淀的颜色,试验Cu(OH)2的酸碱性,另取部分沉淀试验其脱水性。
(2)用0.1mol·dm-3
AgNO3、0.1mol·dm-3 HgCl2和0.1mol·dm-3 Zn(NO3)2溶液代替CuSO4溶液,重复上述实验,分别试验这些氢氧化物的酸碱性及脱水性。
通过以上实验,比较铜、银、锌、汞的氢氧化物酸碱性及脱水性,并写出有关反应式。
2. Cu2+、Ag+、Zn2+、Hg2+的硫化物制备和性质
(1)与H2S反应:在4支试管中,分别加入1-2滴0.1mol·dm-3 CuSO4、AgNO3、Zn(NO3)2和Hg(NO3)2溶液,然后加入中量饱和H2S水溶液,充分搅拌,并在水浴上加热,使沉淀凝聚,待沉淀沉降后,观察沉淀颜色。弃去上层清液,在每一种沉淀上加数6mol·dm-3 HCl,试验沉淀能否溶于HCl,如果有沉淀不溶,用吸管弃去HCl,再用少量去离子水洗涤沉淀,用吸管弃去溶液,在沉淀上再加数滴6mol·dm-3 HNO3,观察有几种沉淀溶解,最后把不溶于HNO3的沉淀与王水进行反应。分别写出反应式,并用溶度积原理解释上述现象。
(2)Hg2+与Na2S反应:取2滴1mol·dm-3HgCl2溶液于一试管中,滴加0.5mol·dm-3 Na2S溶液直到初生成的HgS沉淀又复溶解,写出反应式。然后在此溶液中加入6mol·dm-3 HCl,使溶液呈酸性,观察现象,写出反应式。
4. Cu2+、Hg2+化合物的氧化性
(1)Cu2+离子的氧化性:
A.碘化亚铜CuI的生成:取5滴0.1mol·dm-3 CuSO4溶液,加入数滴0.1mol·dm-3 KI溶液,观察有何变化?为观察CuI沉淀的颜色,可滴加0.1mol·dm-3 Na2S2O3溶液,以除去反应中生成的I2,反应如下:
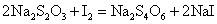
B.氯化亚铜CuCl的生成:在10滴1mol·dm-3CuCl2溶液中,加入10-15滴浓HCl,再加入少许Cu屑,加热煮沸数分钟,直至试管口出现较浓厚的白雾,并且溶液呈泥黄色才停止加热。将此溶液倾入盛有半杯水的小烧杯中,观察是否有白色沉淀产生?写出反应式?
(2)Hg2+离子的氧化性:在数滴0.1mol·dm-3 HgCl2溶液中,滴加0.1mol·dm-3
SnCl2溶液,观察是否有白色沉淀产生?然后再过量数滴并稍加热(或等待片刻),注意沉淀颜色是否转变为灰黑色(Hg2Cl2和Hg的混合物)。解释实验现象,并写出反应式。
5. Cu2+、Ag+、Zn2+、Hg2+离子的鉴定
(1)Cu2+离子的鉴定:取数滴0.1mol·dm-3 CuSO4溶液,加入几滴K4[Fe(CN)6]溶液,如有红棕色沉淀生成,表示有Cu2+存在。写出反应式。
(2)Ag+离子的鉴定:在试管中加入数滴0.1mol·dm-3
AgNO3溶液,滴加2mol·dm-3
HCl至沉淀完全,弃去上层清液,然后在沉淀上加入6mol·dm-3氨水,待沉淀溶解后,加入数滴0.1mol·dm-3 KI溶液,如有淡黄色AgI沉淀生成,表示Ag+离子存在。写出反应式。
(3)Zn2+离子的鉴定:在数滴0.1mol·dm-3 Zn(NO3)2溶液中,加入数滴二苯硫腙的CCl4溶液,当Zn2+与二苯硫腙形成红色螯合物时,CCl4层由绿色变为红棕色,表示有Zn2+离子存在。
(4)Hg2+离子的鉴定:(见4(2)Hg2+离子的氧化性)。
五、思考题
1.Cu(OH)2、Zn(OH)2能否溶于酸或碱中?
2.将氨水分别加入到CuSO4、AgNO3、Zn(NO3)2溶液中去,各产生什么现象?HgCl2溶液中加入氨水,是否生成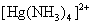 配离子? 配离子?
3.用电极电势变化讨论为什么Cu2+与I-离子反应以及Cu2+与浓HCl和Cu屑反应能顺利进行?
4.怎样分离和鉴定Cu2+Ag+离子;Fe3+、Cu2+和Cr3+离子。
5.混合液中含有Cu2+、Ag+、Zn2+和Hg2+离子,试把它们分离?
|