|
一、实验目的
(1)掌握锡、铅、锑、铋的氢氧化物的生成和酸碱性以及它们盐类的水解性。
(2)掌握锡(II)的还原性和铅(IV)的氧化性。
(3)掌握锡、铅、锑、铋硫化物的生成和性质。
(4)学习锡、铅、锑、铋的分离和鉴定方法。
(5)学习铅(II)盐的溶解性。
二、实验原理
锡、铅、锑、铋这4个元素都是周期表中p区金属元素,锡、铅是第IV A族元素,其价电子层结构分别为5s2 5p2和6s2 6p2,都能形成+2和+4氧化数的化合物。锑、铋是VA族元素,其价电子层分别为5s2 5p2和6s26p2,都能形成+3和+5氧化数的化合物。从锡到铅和从锑到铋,由于“惰性电子对效应”的影响,其高氧化态化合物的稳定性减小,低氧化态化合物的稳定性增加。
1 Sn(Ⅱ)、Pb(Ⅱ)、Sb(Ⅲ)、Bi(Ⅲ)氢氧化物的酸碱性
Sn、Pb、Sb、Bi的低氧化态氢氧化物均是难溶于水的白色化合物。除Bi(OH)3(s)为碱性氢氧化物以外,其他氢氧化物都是两性氢氧化物,它们既可以溶解在相应的酸中,也可以溶解在过量的NaOH溶液中。在过量的NaOH溶液中,发生如下的反应:

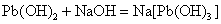
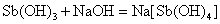
这些元素的氢氧化物的酸碱性也有明显的变化规律:

2.Sn(II)、Sb(Ⅲ)、Bi(Ⅲ)氯化物的水解性
Sn(II)、Sb(Ⅲ)、Bi(Ⅲ)卤化物和它们与强酸生成的可溶性盐的水溶液中都易发生水解,生成相应的碱式盐沉淀
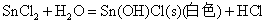
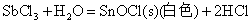
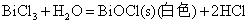
因此在配制相应的溶液时,为了抑制其水解反应,必须加入相应的酸。而对于SnCl2由于其水解反应是不可逆的,即生成的碱式盐沉淀不能溶解于相应的酸中,所以配制SnCl2溶液时应先将SnCl2溶解于不量的浓HCl中,然后再加水稀释。
3 Sn(II)、Sn(IV)、Sb(II)、Sb(Ⅲ)、Bi(Ⅲ)硫化物的生成和性质
Sn(II)、Sn(IV)、Sb(II)、Sb(Ⅲ)、Bi(Ⅲ)都能与适量的Na2S作用,生成不溶于稀盐酸的有色硫化物:
SnS
SnS2
PbS Sb2S3 Bi2S2
暗棕
黄色
黑色 橙色 棕黑
这些硫化物的酸碱性变化规律与其氧化物的酸碱性变化规律相同。同族元素的硫化物(氧化数相同)从上而下酸性减弱,碱性增强,同种元素的硫化物,高氧化物的硫化物(如SnS2)的酸性比低氧化物数硫化物(如SnS)的强。
SnS2
Sb2S3能溶于Na2S溶液中,生成相应的硫代酸盐。
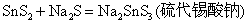
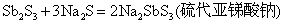
在酸性介质中,硫代酸盐不稳定,发生分解,放出H2S气体和折出相应的硫化物沉淀:
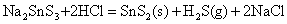
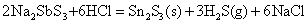
SnS、PbS和Bi2S3不溶于Na2S溶液中
硫代酸盐的形成与分解,可以使Sb2S3(辉锑矿)在自然界中进行迁移和富集。
SnS、SnS2、PbS、Sb2S3、Bi2S3,虽然都不溶于水和稀盐酸中,但是都可以溶解于浓盐酸中。
4 氧化还原性
Sn(II)是常用的还原剂,即使是较弱的氧化剂如Fe3+、HgCl2等也能被它还原,相应的反应式为:
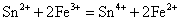
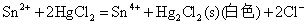

后两个反应是Sn2+对HgCl2的分步还原反应,常用于鉴定溶液中的Hg2+(或Sn2+)。由于Sn2+的水解性和强还原性,在配制Sn2+溶液时,不仅要防止Sn2+的水解,而且还应加入少量的Sn粒,以防止溶液中的Sn2+被空气氧化。
在碱性介质中,Sn2+的还原性更强,可以将Bi3+还原为Bi:

或者:
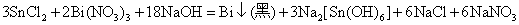
这个反应可以用来鉴定溶液中的Bi3+。
Pb(IV)具有很强的氧化性,在酸性介质中,PbO2可以将Mn2+氧化为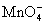 : :
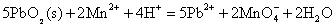
这个反应可以用来鉴定溶液中的Mn2+。
5 Pb(II)盐的溶解性
除了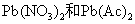 于水溶于水外,其他Pb(II)盐均难溶于水,例如: 于水溶于水外,其他Pb(II)盐均难溶于水,例如:
PbCl2
PbSO4 PbCO3 PbS PbI2 PbCrO4
白色 白色 白色 黑色 黑色 黑色
PbCl2虽然溶于冷水,却可溶于热水,其溶解度随温度变化较大。这一点是PbCl2与其他难溶氯化物(如AgCl)不同之处。在Pb(II)的难溶盐中,PbCrO4的溶解度较小,又有鲜明的颜色,故常用来鉴定Pb2+。
三、仪器和药品
1 仪器:
试管;试管夹;酒精灯;离心试管;离心机。
2 药品:
H2SO4(2.0mol·dm-3) HNO3(2、6 mol·dm-3)
NaOH(2、6 mol·dm-3) HCl(浓、2
mol·dm-3)
BiCl3(s)
Bi(NO3)3(0.1
mol·dm-3)
K2CrO4(0.1 mol·dm-3)
HgCl2(0.1 mol·dm-3)
KI(0.1 mol·dm-3)
Na2S(0.5 mol·dm-3)
MnSO4(0.1
mol·dm-3) PbO2(s)
Pb(NO3)2(0.1 mol·dm-3) SnCl2(S、0.1 mol·dm-3)
SnCl4(0.1
mol·dm-3) SbCl3(s、0.1
mol·dm-3)
pH试纸
四、实验内容
1 氢氧化物的生成及其酸碱性
有浓度均为0.1 mol·dm-3的SnCl2,Pb(NO3),SbCl3,BiCl3及浓度为2.0 mol·dm-3的NaOH,HCl和HNO3。用试管制备少量M(OH)x。并分别试验它们的酸碱性,写出实验步骤,试剂用量及实验现象,将实验结果填入下表:
|
氢氧化物
|
溶解情况
|
氢氧化物酸碱性
|
|
化学式
Sn(OH)2
Pb(OH)2
Bi(OH)3
Sb(OH)3
|
颜色
|
NaOH
|
HCl(HNO3)
|
|
|
|
|
|
|
2 盐的水解
①取绿豆粒大的固体SbCl3于试管中,加1cm3馏水溶解,观察实验现象,并用pH试纸测溶液的pH值,然后逐滴加浓HCl到溶液澄清,再加入蒸馏水稀释,又有何现象。解释实验现象,并写出反应方程式。
②用BiCl3代替SbCl3重复上述实验。
③从上面实验小结水解性盐溶液的配制方法,并设计方案配制0.1 mol·dm-3 SnCl2溶液30ml(注:Sn2+易被空气中的氧化所氧化,长期放置时,应在溶液中加锡粒)。所配溶液留作下面实验用。
3 Sn(II)、Sn(IV)、Pb(II)、Sb(Ⅲ)、Bi(Ⅲ)硫化物的生成与性质
于3支离心试管中加入5滴自己配制的0.lmol·dm-3
SnCl2溶液,然后滴加0.5mol·dm-3 Na2S溶液到有沉淀析出,观察沉淀的颜色,离心分离;弃去上层清液,分别加入2mol·dm-3 HCl、浓HCl和0.5mol·dm-3
Na2S溶液,记录有关现象,再在加入0.5mol·dm-3 Na2S溶液的离心试管中加人数滴2mol·dm-3
HCl,有何现象,写出有关的化学反应方程式。
分别用0.1mol·dm-3
SnCl4溶液,0.1mol·dm-3 Pb(NO3)2溶液0.1mol·dm-3
SbCl3,溶液和0.1mol·dm-3 Bi(NO3)3溶液代替SnCl2溶液,重复上述操作,记录有关现象,写出有关化学反应方程式。
通过以上试验掌握SnS、SnS2、PbS、Sb2S3、Bi2S3的颜色,总结它们的溶解性质。
4氧化还原性
①Sn(Ⅱ)的还原性-Bi(Ⅲ)、Sn(Ⅱ)(或Hg(II)的鉴定):
A.于试管中加人10滴自己配制的0.1mol·dm-3
SnCl2;溶液和4滴0.1mol·dm-3 Bi(NO3)3溶液,观察有何现象,再加入过量的6mol·dm-3
NaOH溶液,又有何现象发生,写出相应的化学反应方程式。
B.在试管中加入5滴0.1mol·dm-3
HgCl2溶液,再逐渐加入自己配置的0.1mol·dm-3 SnCl2 溶液,微热,观察沉淀颜色的变化,写出化学反应方程式。
②Pb(Ⅳ)的氧化性-Mn(Ⅱ)的鉴定:在试管中加入约1ml 6mol·dm-3 HNO3和3滴0.1mol·dm-3
MnSO4溶液,再加少量的PbO2(固体),微热,静置片刻,待溶液澄清后,观察溶液的颜色,写出化学反应方程式。
5 难溶铅盐的性质
于4支试管中各加入5滴0.1mol·dm-3
Pb(NO3)2溶液;分别加入一定量的2mol·dm-3
HCl、2mol·dm-3 H2SO4、0.1mol·dm-3
KI、0.1mol·dm-3
K2CrO4溶液,观察沉淀的生成和颜色,写出化学反应方程式。
试验PbCl2在冷、热水中的溶解情况,记录有关现象。
五、预习要求
1 学习《无机化学》元素部分的有关内容
2 复习离心机,加热等操作
六、预习思考题
1 沉淀氢氧化物是否一定要在碱性条件下进行?是否是加入碱的量越多,氢氧化物的沉淀就越完全?
2 试验Pb(OH)2的酸碱性时,用哪一种酸较合适?为什么?
3 怎样配制能较长时间保存的SnCl2溶液?
4 如何鉴别SnCl2和SnCl4?
5 如何分离并鉴定Sn2+、Pb2+?
6 拟定分离Pb2+、Bi3+、Bb3+的实验方案。
7 在SnS、SnS2、PbS、Sb2S3中,哪些能溶于Na2S中,溶解后生成什么化合物?加酸以后又会发生什么变化?
|