|
课程编号:13001
学时数: 130
学分数:6.5
本大纲是根据教育部的有关精神,参照过去制定的教学大纲及《物理化学》和《普通化学》的教学基本内容并结合我校的具体情况制定而成。
一、课程性质和目的
《大学化学》是地质、资源、环境、材料、生物和能源等学科本科生的一门公共基础课。本课程的目的是:通过本课程的学习,使学生系统地掌握《物理化学》和《普通化学》的基本原理和方法,掌握科学的实验方法和基本实验技能,初步具有分析和解决实际问题的能力;培养学生良好的科学素养和扎实的化学基础,为后续课程的学习打下牢固的理论基础。
本大纲适用于地球化学、地质学、矿藏、石油、环境、材料科学与工程、水文、水文工程、生物、能源等本科专业。
本课程要求学生具备高等数学、物理学等基础知识。
二、课程的基本内容
本课程的基本内容是:
第一章 原子结构和元素周期律
§1.1
原子结构的早期模型
原子的含核模型、原子的玻尔模型;
§1.2
微观粒子的波粒二象性 微观粒子的波粒二象性、德布罗依波的统计解释、测不准关系;
§1.3
现代原子结构模型—氢原子核外电子的运动状态 薛定谔方程、波函数与原子轨道、概率密度和电子云、原子轨道和电子云的图象、四个量子数的物理意义;
§1.4
原子结构和元素周期系 多电子原子的原子轨道及能量、多电子原子的能级、核外电子排布的规则、原子的电子结构和元素周期系、元素的族及元素的分区、元素周期律的实质;
§1.5
元素的性质与原子结构的关系
原子半径、电离能I、元素的电子亲和能EA、元素的电负性X、元素的氧化数与原子结构的关系。
第二章 分子结构和分子间力
§2.1
键参数 键能E、键长、键角、键矩;
§2.2
离子键 离子的类型、离子键理论;
§2.3
价键理论 价键理论基本要点、共价键的特征、共价键的类型;
§2.4
杂化轨道理论 杂化轨道理论基本要点、 sp杂化、 sp2杂化、 sp3杂化、 不等性杂化;
§2.5
分子轨道理论 分子轨道理论要点、
分子轨道的类型及能级次序、 双原子分子的结构;
§2.6
分子间作用力和氢键 分子间作用力、 氢键。
第三章 固体结构和固体性质
§3.1
晶体的特征和分类
晶体的特征、
晶体的内部结构、
晶体的分类;
§3.2
离子晶体 离子晶体的特征和性质、 几种典型的离子晶体、 离子半径、 离子半径与配位比的关系、 晶格能;
§3.3
离子的极化 离子的极化作用和变形性、 离子极化对物质结构和性质的影响;
§3.4
原子晶体和分子晶体 原子晶体、 分子晶体;
§3.5
金属键和金属晶体 自由电子理论、 能带理论、 金属晶体的密堆积结构、 金属原子半径;
§3.6
其它类型的晶体 混合键型晶体、 球碳;
§3.7
晶体缺陷和非化学计量化合物 晶体缺陷、 非化学计量化合物;
第四章
配位化合物
§4-1 配位化合物的基本概念 配位化合物定义和组成、
配合物的命名、 配合物的空间构型、 配合物的类型、 配合物的磁性;
§4-2 配位化合物的价键理论 价键理论基本要点、 配合物的空间构型、 内轨杂化与外轨杂化;
§4-3 晶体场理论 晶体场理论的基本要点、
轨道分裂参数、 配合物的自旋态、 晶体稳定化能(CFSE)、 晶体场理论的应用;
第五章 热力学第一定律与热化学
§5.1 热力学概论
热力学研究的对象和内容、 热力学基本概念;
§5.2 热力学第一定律 热力学第一定律的文字表述、 热力学能、 热和功、 可逆过程、 热力学第一定律的数学表达式;
§5.3 焓 等容反应热、 等压反应热与焓;
§5.4 热容 热容的定义、 热容与温度的关系、 理想气体的Cp与CV的关系
§5.5 热力学第一定律的一些应用 理想气体的热力学能和焓、 理想气体的等值过、 绝热过程、 相变过程
§5.6 热化学概论 化学反应进度、 等压反应热和等容反应热、 标准状态、 热化学方程式、 盖斯定律、 热效应与温度的关系;
§5.7 热化学基本数据与反应焓变的计算 标准摩尔生成焓、 标准摩尔燃烧焓、
离子的标准摩尔生成焓;
第六章 热力学第二定律与化学反应的方向和限度
§6.1 过程的方向性 热力学第二定律 自发过程的不可逆性、 热力学第二定律、 热力学第二定律的统计解释;
§6.2 熵 熵、 熵判据;
§6.3 熵变的计算 简单状态变化、 相变化、 化学变化
§6.4 热力学第三定律和规定熵
热力学第三定律、
规定熵和标准摩尔熵、 标准摩尔反应熵;
§6.5 亥姆霍兹函数和吉布斯函数 亥姆霍兹函数F、 亥姆霍兹函数判据、 吉布斯函数G、 吉布斯函数判据、 F 和G 的计算;
§6.6 标准摩尔吉布斯函数
标准摩尔生成吉布斯函数、
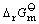 的计算、 化学反应方向的判据; 的计算、 化学反应方向的判据;
§6.7 热力学基本方程 热力学基本方程、 温度与G 的关系——吉布斯—亥姆霍兹方程、 压力与G 的关系;
§6.8 偏摩尔量 偏摩尔量的定义、 偏摩尔量的集合公式;
§6.9 化学势
化学势的定义、
化学势判据;
§6.10 逸度和活度 理想气体的化学势、 实际气体的化学势 、逸度、 理想稀薄溶液的化学势、 理想溶液任一组分的化学势、 实际溶液的化学势、活度;
§6.11
溶液
溶液浓度表示法、
拉乌尔定律与亨利定律、
非电解质稀溶液的依数性;
第七章 化学平衡
§7.1 可逆反应和化学平衡
可逆反应、
化学平衡;
§7.2 标准平衡常数
化学反应等温式和标准平衡常数、 用等温式判断化学反应的方向和限度、
标准平衡常数的理论计算、 标准平衡常数的几种表示方法、 标准平衡常数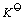 的表达式使用中的若干问题; 的表达式使用中的若干问题;
§7.3 化学平衡的移动 浓度对化学平衡移动的影响、 压力对化学平衡移动的影响、
惰性气体对化学平衡移动的影响、 温度对化学平衡移动的影响、 平衡移动原理;
§7.4 有关化学平衡的计算 平衡常数的计算、 平衡混合物的计算、 同时平衡;
第八章 水溶液中的离子平衡
§8.1 酸碱质子理论 质子酸,质子碱的定义、
共轭酸碱概念及其相对强弱、 酸碱反应的实质;
§8.2
弱酸和弱碱的解离平衡 一元弱酸,弱碱的解离平衡、 共轭酸碱解离常数与Kw的关系、 多元弱酸,弱碱的解离平衡;
§8.3 缓冲溶液 同离子效应、
缓冲溶液、 缓冲溶液的pH值计算、 缓冲溶液的应用和选择;
§8.4
沉淀-溶解平衡
标准溶度积、 溶度积和溶解度之间的换算、 沉淀的生成和溶解、8.4.4 同离子效应、 控制沉淀溶解平衡中的pH值-沉淀的酸溶解、 分步沉淀、 难溶化合物的转化;
§8.5
配合物的解离平衡
配合物的标准稳定常数和有关离子浓度的计算、 配合物的平衡移动;
第九章 氧化还原平衡和电化学基础
§9.1 氧化还原反应 氧化与还原的概念、 氧化还原反应方程式的配平;
§9.5 原电池和电极电势 原电池、原电池的电动势和电极电势、标准电极电势;
§9.6 可逆电池热力学 可逆电池、可逆电池电动势与吉布斯自由能变化的关系、可逆电池电动势E与参加反应各组分活度的关系、DrSm和DrHm与电动势的关系;
§9.7 影响电极电势的因素 浓度对电极电势的影响 — 电极电势的能斯特方程式、pH对电极电势的影响、沉淀和配合物的生成对电极电势的影响;
§9.8 电极电势的应用 判断氧化剂和还原剂的强弱、
判断氧化还原反应进行的方、判断氧化还原反应进行的程度、元素的标准电势图及其应用、水的电势—pH图
§9.9 浓差电池
电极浓差电池、电解质浓差电池;
§9.10 电池电动势测定的应用 电解质溶液平均活度系数的测定、求难溶盐的标准溶度积、pH值的测定;
第十章 相平衡
§10.1 相律 相、组分和自由度、相律;
§10.2 单组分系统 水的相图、硫的相图;
克拉贝龙(Clapeyron)方程式
§10.3 二组分液—气和液—液系统 理想液体混合物的液—气平衡、真实液体混合物的液—气平衡、部分互溶的液—液系统;
§10.4 二组分液—固系统 简单低共熔系统、热分析、溶解度法、形成化合物的二组分系统、形成化合物的二组分系统、固相完全互溶的固-液平衡、固相部分互溶的固-液平衡;
§10.5 三组分系统 三组分系统的相图表示法、部分互溶的三组分系统;
第十一章 化学动力学
§11.1 化学反应速率及其机理 化学反应速率的定义及其表示方法、反应速率的实验测定;
§11.2 反应历程和基元反应 反应历程和基元反应、简单反应与复合反应、反应分子数;
§11.3 浓度对反应速率的影响 质量作用定律和反应速率常数、反应级数;
§11.4 速率方程的微积分形式及其特征 简单级数反应的速率方程、简单级数反应速率方程的确定;
§11.5 温度对反应速率的影响 温度与反应速率之间的经验关系式、活化能的物理意义、活化能对反应速率的影响;
§11.6 化学反应速率理论 简单碰撞理论、过渡状态理论;
§11.7 催化反应 催化剂和催化反应、催化剂的特性;
第十二章 单质及无机化合物概论
§12.1 元素的存在状态和分布 元素、元素的赋存状态与分布;
§12.2 主族元素单质的性质 单质的晶体结构与物理性质、单质的化学性质、12.2.3 稀有气体;
§12.3 过渡元素概论 过渡元素的通性、重要的过渡元素;
§12.4 镧系元素 镧系元素的通性、镧系元素的重要化合物、镧系元素的制取、镧系元素的应用;
§12.5 锕系元素 锕系元素的通性、钍和铀的重要化合物;
§l2.6 氧化物和氢氧化物 氧化物的物理性质、氧化物的酸碱性及其变化规律、氢氧化物的酸碱性;
§12.7 卤化物 卤化氢与氢卤酸、卤化物的物理性质、卤化物的化学性质;
§12.8 硫化物 硫化氢和氢硫酸、硫化物;
§12.9 含氧酸盐的制备 含氧酸的强度、 含氧酸及其盐的氧化还原性、 含氧酸盐的溶解性、 含氧酸及其盐的热稳定性、 硅酸盐
§12.10 新型无机非金属材料 精细陶瓷、 光学材料、 纳米材料。
三、课程的基本要求
第一章
化学反应速度与化学原子结构和元素周期律:通过氢原子光谱和玻尔理论的讨论建立近代微观粒子结构的初步概念;了解微观粒子的波粒二象性、能量量子化、统计解释和测不准原理。掌握波函数、原子轨道、电子云、能级的基本概念。掌握n、l、m、ms四个量子数及其物理意义;理解s、p、d原子轨道和电子云角度和径向分布图的特征。掌握原子轨道的能级组,了解屏蔽效应、钻穿效应及有效核电荷的计算。掌握核外电子的分布原则及电子分布式的书写,元素周期律和周期表,原子的电子结构和元素周期系、元素性质与原子结构的关系;理解原子半径、镧系收缩、元素的电离能、电子亲和能、电负性、氧化数、金属性和非金属性的概念及其周期变化规律。
第二章 分子结构和分子间力:了解离子键的形成及其特征。掌握共价键的形成条件和本质及现代价键理论的要点,明确共价键的类型,了解键能、键长及键角等键参数。掌握杂化轨道的概念、杂化轨道的基本类型及其与空间构型的关系。理解分子轨道理论的基本要点,并能用其解释第一、二周期同核双原子分子的结构和性质。掌握分子间作用力和氢键对物质某些性质的影响。
第三章 固体结构和固体性质:掌握晶体的基本概念、晶体的特征,掌握晶体的基本类型、性质和特点;理解玻恩-伯循环并能进行有关的计算。掌握离子极化概念以及对晶体性质的影响。了解金属键的形成、特性、金属键理论要点和金属能带理论。了解晶体缺陷的概念及其应用。
第四章 配位化合物:掌握简单配合物的组成、命名和基本性质。掌握配合物价键理论的基本要点,并能用其解释配合物的磁性、空间构型、稳定性等性质;掌握晶体场理论的基本内容,并能用其解释酸位化合物的自旋态、稳定性、颜色等性质。了解配合物的一些实际应用和新型配合物。
第五章 热力学第一定律与热化学:初步了解热力学的研究方法及其特点;理解热力学第一定律的实质并能应用于处理各种物理、化学过程。掌握系统与环境、过程与途径、状态与状态函数、可逆过程、功与热、热力学能、焓、平衡态、热力学标准态,反应进度等热力学基本概念。掌握热力学第一定律的数学表达式。掌握热容的概念,明确不同条件下Cp与CV的关系;能计算理想气体在恒温、恒压、恒容和绝热过程中的Q、W、DU和DH。理解DfHmθ、DcHmθ和DrHmθ的概念;能应用热力学基础数据计算相变和化学变化过程的DH。
第六章 热力学第二定律与化学反应的方向和限度:了解自发过程的共同特征,热力学第二、第三定律的文字表述。掌握熵函数的概念:熵变的引入、定义和熵增原理的本质,能熟练地应用克劳修斯不等式。掌握亥姆霍兹函数和吉布斯函数的定义以及应用DS和DG作为过程方向和限度判据的适用条件;了解DA、DG的物理意义。掌握单纯的p-V-T变化、相变化和化学变化过程中DS和DG的计算方法;理解DfGm°、DrGm°以及Sm°、DrSm°的意义及其应用。掌握热力学基本方程;理解吉布斯——赫姆霍兹方程及其应用。掌握偏摩尔量和化学势的概念;了解逸度、活度及标准态的概念;理解化学势在处理平衡问题和研究多组分系统性质中的作用。了解稀溶液的依数性。
第七章 化学平衡:掌握用热力学平衡的原理导出化学反应等温式、标准摩尔反应吉布斯函数和标准平衡常数的方法,能运用反应等温式判断反应的方向和限度。掌握温度对平衡常数的影响——范特霍夫等压方程式。了解各种因素对化学平衡的定量影响和平衡移动的原理;能进行与平衡常数、平衡组成和平衡转化率有关的计算。
第八章 水溶液中的离子平衡:掌握酸碱质子理论:质子酸碱的定义,共轭酸碱对的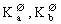 关系,能用解离常数判断弱酸(碱)相对强弱,缓冲溶液的概念;理解影响质子酸、碱与水反应的因素及其溶液pH的计算;掌握难溶电解质的多相离子平衡概念与溶度积规则;理解沉淀生成与溶解的条件;了解影响沉淀溶解度的因素以及分步沉淀的次序。并能进行有关的计算。掌握配位平衡的概念以及配离子在水溶液中的解离平衡与有关计算。 关系,能用解离常数判断弱酸(碱)相对强弱,缓冲溶液的概念;理解影响质子酸、碱与水反应的因素及其溶液pH的计算;掌握难溶电解质的多相离子平衡概念与溶度积规则;理解沉淀生成与溶解的条件;了解影响沉淀溶解度的因素以及分步沉淀的次序。并能进行有关的计算。掌握配位平衡的概念以及配离子在水溶液中的解离平衡与有关计算。
第九章 氧化还原平衡和电化学基础:能够熟练地应用离子-电子法配平氧化还原反应方程式。了解电导、电导率、摩尔电导率、法拉第定律、掌握可逆电池、电极电势等概念;了解电动势产生的机理;理解原电池的有关概念;掌握能斯特方程及应用、可逆电池电动势与电池反应热力学函数的关系,并能熟练的进行有关的计算;理解用DrGm°、E°及K°估计氧化还原反应程度的原理,并能熟练的进行有关的计算;理解常见的几类电极。
第十章
相平衡:掌握相数、组分数、自由度以及杠杆规则等基本概念。掌握相律的意义及其应用。掌握克拉贝龙方程和克拉贝龙—克劳修斯方程,能进行有关的计算。掌握水的相图中点、线、面的意义,能分析单组分相图。理解二组分液态完全互溶的气液平衡相图、二组分固态完全不互溶的固液平衡相图、形成化合物的二组分相图和具有转熔温度的二组分相图。掌握精馏的基本原理和热分析法绘制相图的原理。了解三组分平衡相图的表示方法。
第十一章
化学动力学:掌握化学反应速率、速率常数和反应级数、基元反应和反应分子数的概念。掌握零级、一级和二级反应速率方程的特点及其应用,并能进行有关的计算;了解通过实验建立速率方程的基本原理和方法。理解阿伦尼乌斯方程及其应用,包括活化能的定义和物理意义;了解碰撞理论和过渡状态理论。了解对行反应、连串反应和平行反应的动力学特征。
第十二章
单质及无机化合物概论:了解元素的分类、在自然界的存在形式及其应用。了解元素的同素异形体、元素的丰度、稀有气体、稀土元素、对角线规则等基本概念。理解元素单质的几种类型及其性质的递变规律。理解非金属单质的结构与性质的关系及主要的化学反应。了解主族和副族金属单质性质的递变规律。理解卤化物键型及其变化规律、结构和性质。理解氧化物和氢氧化物的分类、性质及其变化规律。了解硫化物的溶解性及其变化规律。掌握含氧酸及其盐的氧化还原性、酸碱性、热稳定性、溶解性。了解某些新型无机材料的一些常识。
四、教学安排
本课程的总学时为130h,分两个学期完成。
第一学期:理论课50h;实验课 20h。 第二学期:理论课40h;实验课 20h。
理论课安排
|
序号
|
课 程 内 容
|
学时
|
|
第一学期
|
|
1
2
3
4
5
6
|
第五章
热力学第一定律与热化学
第六章
热力学第二定律与化学反应的方向和限度
第七章
化学平衡
第八章
水溶液中的离子平衡
第九章
氧化还原平衡和电化学基础
第十一章
化学动力学
|
8
14
5
8
10
5
|
|
实验课安排
|
|
1
2
3
4
5
6
7
|
称量练习与酸碱滴定
醋酸电离常数和电离度的测定
燃烧焓的测定
液体饱和蒸汽压的测定
配离子的组成与稳定常数的测定实验
电化学(Ⅰ)
反应级数及活化能的测定
|
4
2
4
4
2
2
2
|
|
第二学期
|
|
1
2
3
4
5
6
|
第九章相平衡
第一章
原子结构和元素周期律
第二章
分子结构和分子间力
第三章
固体结构和固体性质
第四章
配位化合物
第十二章
单质及无机化合物概论
|
10
8
8
4
6
4
|
|
实验课安排
|
|
1
2
3
4
5
|
双液系气-液平衡相图
二组分金属相图
Sn,Pb,Sb,Bi;Cr,Mn
常见阳离子的分离与检出
铁矿石中铁含量的测定
|
4
4
4
4
4
|
五、教材和参考资料
教材:大学化学.基础化学教研室编.中国地质大学校内教材,2003年
大学化学实验.安黛宗等编.中国地质大学校内教材,2004年
参考资料:
1.结构化学.江元生著.北京:高等教育出版社,1997年
2.结构化学基础.周公度,段连运编著.北京:北京大学出版社,1995
3.物理化学.南京大学物理化学教研室
傅献彩等编.第4版.北京:高等教育出版社,1990
4.物理化学.胡英等编.第4版.北京:高等教育出版杜,1999
5.物理化学简明教程.山东大学
印永嘉,奚正楷,北京师范大学李大珍编.第3版北京:高等教育出版社,1992
6.物理化学.天津大学物理化学教研室编.上、下册.第4版,北京:高等教育出版社,2001
7.物理化学.金继红、陈达士、阎庚舜等编.北京:地质出版社,1993
8.普通化学.张永巽,张维宽编.北京:高等教育出版社,1986
9.现代化学基础.胡忠鲠主编,金继红,李盛华副主编.北京:高等教育出版社,2000
10.大学化学.傅献彩主编.北京:高等教育出版社,1999
11.现代化学基础.沈光球,陶家洵,徐功骅.北京:清华大学出版社,1999
12.无机化学.武汉大学,吉林大学等校编.第3版.北京:高等教育出版社,1994
13.普通化学.浙江大学普通化学教研组编.第4版.北京:高等教育出版社,1996
14.无机化学(第四版).大连理工大学.北京:高等教育出版社,2001
|