一、实验目的
1.学习简易恒电流库仑仪的安装和使用;
2.掌握恒电流库仑滴定法测定痕量砷的实验方法。
二、方法原理
本实验是采用恒电流电解溴化钾产生的溴来测定砷的含量。溴化钾在工作电极上被氧化产生Br2:
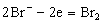
电解产生的Br2立即与溶液中As(III)反应,把As(III)氧化为As(V):

到达终点后,电解产生多余的Br2会使指示系统电流显著增加。指示系统(永停终点法)中两个电极都是铂电极,外加电压仅0.2V。当滴定没有过量的Br2时,要在指示电极上有电流通过,外加电压必须大于0.89V,因此终点前没有电流通过指示电极;终点时,有微量Br2出现,指示系统两个电极分别进行下列反应:
阴极: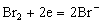
阳极:
故在较低电压(如0.2V)下,即有明显电流渡过,指示终点到达。根据电解电流及电解时间计算电解电量,进而计算出砷的含量。
用45V以上的干电池或恒电压直流电源作为电解电源,通过溶液的电解电流可藉可变电阻器调节,并由已校正的毫安计指示电流值。采用高压电源可减少因电解过程中电解池的反电动势的变化而引起的电解电流的变化,这样才能准确计算滴定过程中所消耗的电量。为了防止各种干扰电极反应的因素发生,必须将电解池的阳极与阴极分开。
三、仪器设备与试剂材料
1.干电池或恒压直流电源(45V以上);毫安表;检流计;电位器;电磁搅拌器;铂工作电极与指示电极各一对;秒表;毫伏表。
2.0.2mol∙L-1 KBr;浓H2SO4;100μg∙mL-1 As(III)溶液:准确称取As2O3 0.1320g置于100mL烧杯中,加5mL 20% NaOH,温热至As2O3全部溶解后,以酚酞为指示剂,用1mol∙L-1 H2SO4中和至无色,再过量10mL,转入1L容量瓶中,用蒸馏水稀释至刻度,摇匀,备用。
四、实验步骤
1.按照“简易库仑滴定装置图”接好各设备,将搅拌磁子放入电解池中,加入0.2mol∙L-1
KBr溶液100mL,H2SO4
3mL。

简易库仑滴定装置图
1-铂片电极;2-铂片电极与阴极隔离室;3-铂丝指示极对;4-搅拌磁子;
5-精密直流毫安表(30mA,0.5级);6-检流计(灵敏度10-9A/mm);7-直流伏特
2.接通K1,调节滑线电阻10使加在双铂指示电极上的电压为150mV左右,旋转检流计6的“零点”调节器使光点指示为“0”。
3.接通K2,调节滑线电阻11,使电解电流在10mA左右,此时因在铂工作阳极上产生Br2,从而使指示电极上的检流计光点发生偏转,所以应当注意观察光点的移动并立即断开K2。
4.调节检流计6的“灵敏度”分档开关,使光点达到最大偏转,然后逐滴加入砷试样溶液使检流计光点回零。
5.接通K2,当检流计光点恰好移至刻度值为50格的瞬间立即断开K2(此即预定终点)。
6.用移液管准确加入砷试样溶液5.00mL于电解池溶液中,在接通K2的同时开动秒表计时,进行库仑滴定,记下恒电流I的数值,观察检流计的光点,当光点移至预定终点值时,立即停止秒表断开K2,记下电解滴定时间,重复测定二次。
五、数据处理
1.根据对应关系记录实验数据与现象。
2.按法拉第电解定律计算砷试样溶液的平均浓度(μg∙mL-1)。
六、问题讨论
1.本实验的电解电路是怎样获得恒定电流的?
2.双铂指示电极为什么能指示终点?
3.讨论本实验中可能的误差来源及其预防措施?