一、实验目的
1.了解半波电位的意义及其应用;
2.掌握直接比较法定量测定铜的原理和方法。
二、方法原理
在极谱分析中,对于绝大多数可还原金属离子的可逆电极反应(还原所得金属不溶于汞的反应除外),其半波电位为:
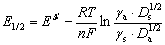
式中γs、Ds和γa、Da分别为金属离子在溶液的活度系数与扩散系数和金属在汞齐中的活度系数与扩散系数。在一定底液及实验条件下,E1/2与浓度无关,是某一还原物质的特性。故可根据半波电位进行定性分析。
在实际工作中,大都通过半波电位了解在某种溶液体系中有关物质产生极谱波的电位,从而制定具体分析步骤和考虑其它共存物质的干扰,很少采用极谱法进行定性分析。
铜在以氨及氯化铵为支持电解质、用亚硫酸钠除氧、明胶作为极大抑制剂的底液中,产生两个可逆的极谱波。第一个波相当于铜(II)还原为铜(I),第二个波相当于铜(I)还原为金属铜,其电极反应如下:
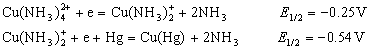
在上述条件下,Cd2+、Ni2+、Zn2+等的半波电位分别为:-0.84V、-1.12V及-1.39V(以上均对SCE)。
三、仪器设备与试剂材料
1.883型极谱仪;滴汞电极;饱和甘汞电极。
2.2mol∙L-1 NH4Cl-2mol∙L-1
NH4OH溶液;浓度为0.01mol∙L-1的Cu2+、Cd2+、Ni2+和Zn2+溶液;0.5%明胶溶液;1.00×10-3mol∙L-1 Cu2+标准溶液。
四、实验步骤
1.定性分析实验
用移液管分别准确吸取Cu2+、Cd2+、Ni2+及Zn2+溶液各1.0mL于25mL容量瓶中。加入10.0mL 2mol∙L-1 NH4Cl
- 2mol∙L-1 NH4OH溶液,0.5mL明胶溶液及数十粒Na2SO3,用水稀释至刻度,摇匀。然后倒出部分溶液于电解池,在极谱仪上自-0.2~-1.8V作极谱图。
准确移取铜标准溶液3.0mL置于25mL容量瓶中。与上述手续相同,分别加入氨底液,明胶及Na2SO3等,并稀释至刻度,摇匀,倒入电解池中,在-0.2~-0.8V记录极谱图。
五、数据处理
1.从记录的Cu2+、Cd2+、Ni2+及Zn2+的极谱曲线上,用作图法求出它们的半波电位。
2.用作图法求出标准溶液和未知样品的波高,用直接比较法计算试样中铜的百分含量。
六、问题讨论
1.半波电位与哪些因素有关?在什么情况下能根据半波电位对被测物质进行定性分析?
2.实验中除被测离子外,所加的各种试剂起何作用?
3.为什么不取铜的第一个波进行定量分析?