一、实验目的
1.熟悉电导滴定法的基本原理;
2.掌握电导滴定法测定弱酸解离常数的实验方法。
二、方法原理
溶液的电导随离子的数目、电荷和大小而变化,也随着溶剂的某些特性如粘度的变化而变化。这样可以预料,不同品种的离子对给定溶液产生不同的电导。因此,如果溶液里一种离子通过化学反应被另一种大小或电荷不同的离子取代,必然导致溶液的电导发生显著变化。电导滴定法正是利用这一原理完成欲测物质的定量测定。
一个电解质溶液的总电导,是溶液中所有离子电导的总和。即:
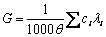 (2-1)
(2-1)
式中ci为第i种离子的浓度(mol∙L-1),λi为其摩尔电导,θ为电导池常数。
弱酸的解离度α与其电导的关系可表示为:
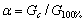 (2-2)
(2-2)
Gc为任意浓度时实际电导值,它是从实验中实际测量的,G100%为同一浓度完全解离时的电导值,它可从不同的滴定曲线计算而得。
醋酸在溶液中的解离平衡为:
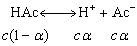
解离常数Ka为:
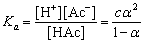 (2-3)
(2-3)
根据电解质的电导具有加和性的原理,对任意浓度醋酸在完全解离时的电导值,能从有关滴定曲线上求得。假如选用氢氧化钠滴定醋酸和盐酸溶液,可从滴定曲线上查得有关电导值后,按下式计算醋酸在100%解离时的电导值。
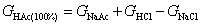 (2-4)
(2-4)
式中GNaAc为醋酸被氢氧化钠滴定至终点的电导值,GNaCl为盐酸被滴定至终点的电导值。(注意:所述电导值应按式(2-1)校正至相同的物质的量浓度,式(2-4)才成立)。
三、仪器设备与试剂材料
1.电导仪;电导电极(铂黑电极)。
2.电磁搅拌器。
3.NaOH标准溶液:0.2000mol∙L-1;醋酸溶液:~0.1mol∙L-1;盐酸溶液:~0.1mol∙L-1。
四、实验步骤
1.预热电导仪,联接电导电极。
2.移取约0.1mol∙L-1醋酸溶液20mL于300mL的烧杯中,加蒸馏水170mL,放烧杯在电磁搅拌器上,插入洗净的电导电极,注意不能影响搅拌磁子的转动。开动电磁搅拌器,调节搅拌速度,使溶液不出现涡流。
3.用0.2000mol∙L-1 NaOH标准溶液滴定,首先记录醋酸未滴定时的读数,然后每次滴定0.5mL,读一次电导数值,直到滴定剂约20mL体积。
4.同步骤2、3,用0.2000mol∙L-1
NaOH标准溶液滴定约0.1mol∙L-1盐酸溶液20mL。
五、数据处理
1.绘制醋酸和盐酸的电导滴定曲线。
2.从两种滴定曲线的终点所消耗的NaOH体积,分别计算醋酸和盐酸的准确浓度。
3.按方法原理中公式(2-1),校正GNaAc、GHCl和GNaCl与GHAc相同的物质的量浓度时的数值,再按式(2-4)求醋酸在100%解离时电导值,进而从式(2-2)和式(2-3)计算出醋酸的解离常数Ka。
六、问题讨论
1.解释用NaOH滴定HAc和HCl的电导滴定曲线为何不同?
2.本实验所用方法测定弱酸的解离常数Ka,有哪些特点?
3.如要准确测定Ka值,在滴定实验中应着重控制哪些影响因素?