一、实验目的
1.进一步学习计算色谱峰的分辨率;
2.熟练掌握根据保留值、用已知物对照定性的分析方法;
3.学习用归一化法定量测定混合物各组分的含量。
二、方法原理
对一个混合试样成功地分离,是气相色谱法完成定性及定量分析的前提和基础。衡量一对色谱峰分离的程度可用分离度R表示:
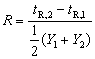
式中tR,2,Y2和tR,1,Y1分别是两个组分的保留时间和峰底宽,如下图所示。当R=1.5时,两峰完全分离;当R=1.0时,98%的分离。在实际应用中,R=1.0一般可以满足需要。
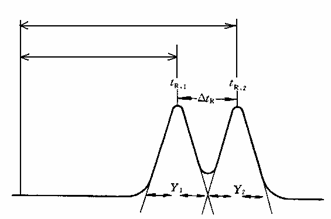
测量tR和分离度
用色谱法进行定性分析的任务是确定色谱图上每一个峰所代表的物质。在色谱条件一定时,任何一种物质都有确定的保留值、保留时间、保留体积、保留指数及相对保留值等保留参数。因此,在相同的色谱操作条件下,通过比较已知纯样和未知物的保留参数或在固定相上的位置,即可确定未知物为何种物质。
当手头上有待测组分的纯样时,用与已知物对照进行定性极为简单。实验时,可采用单柱比较法、峰高加入或双柱比较法。
单柱比较法是在相同的色谱条件下,分别对已知纯样及待测试样进行色谱分析,得到两张色谱图,然后比较其保留参数。当两者的数值相同时,即可认为待测试样中有纯样组分存在。
双柱比较法是在两个极性完全不同的色谱柱上,在各自确定的操作条件下,测定纯样和待测组分在其上的保留参数,如果都相同,则可准确地判断试样中有与此纯样相同的物质存在。由于有些不同的化合物会在某一固定相上表现了相同的热力学性质,故双柱法定性比单柱法更为可靠。
在一定的色谱条件下,组分i的质量mi或其在流动相中的浓度,与检测器的响应讯号峰面积Ai或峰高hi成正比:
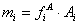
或
式中fiA和fih称为绝对校正因子。此公式为色谱定量的依据。不难看出,响应信号A、h及校正因子的准确测量直接影响定量分析的准确度。
由于峰面积的大小不易受操作条件如柱温、流动相的流速、进样速度等因素的影响,故峰面积更适于作为定量分析的参数。测量峰面积的方法分为手工测量和自动测量两大类。现代色谱仪中一般都配有准确测量色谱面积的电学积分仪。手工测量则首先测量峰高h和半峰宽Y1/2,然后按下式计算:
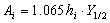
当峰形不对称时,则可按下式计算:
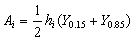
式中Y0.15和Y0.85分别是峰高0.15和0.85处的峰宽值。
由 ,式中mi可用质量、物质的量及体积等物理量表示,相应校正因子分别称为质量校正因子、摩尔校正因子和体积校正因子。由于绝对校正因子受仪器和操作条件的影响很大,其应用受到限制,一般采用相对校正因子。相对校正因子是指组分i与基准组分s的绝对校正因子之比,即: ,式中mi可用质量、物质的量及体积等物理量表示,相应校正因子分别称为质量校正因子、摩尔校正因子和体积校正因子。由于绝对校正因子受仪器和操作条件的影响很大,其应用受到限制,一般采用相对校正因子。相对校正因子是指组分i与基准组分s的绝对校正因子之比,即:
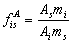
因绝对校正因子很少使用,一般文献上提到的校正因子就是相对校正因子。
根据不同的情况,可选用不同的定量方法。归一化法是将样品中所有组分含量之和按100%计算,以它们相应的响应信号为定量参数,通过下式计算各组分的质量分数:
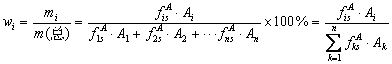
该法简便、准确。当操作条件变化时,对分析结果影响较小,常用于常量分析,尤其适于进样量少而体积不易准确测量的液体试样。但采用本法进行定量分析时,要求试样中各组分产生测量的色谱峰。
三、仪器设备与试剂材料
1.有记录仪的气相色谱仪;热导池检测器。
2.带减压阀的氢气钢瓶。
3.秒表。
4.色谱柱:柱长2m,内径2mm,6201载体上涂有邻苯二甲酸二壬酯(100:(10~15))固定液。
5.注射器:10μL,100μL。
6.带磨口试管若干。
7.正已烷、环已环、苯、甲苯(均为A.R.)。
8.未知的混合试样。
四、实验步骤
1.认真阅读气相色谱仪操作说明。
2.在教师指导下,按照下列色谱条件开启色谱仪:
柱温:85~95℃;
检测器温度:120℃;
气化室温度:120℃;
载气流速:稍高于本章实验2所测量最佳流速。
3.准确配制 正已烷 : 环已烷 : 苯 : 甲苯 为1 : 1 : 1.5 : 2.5(质量比)的标准混合溶液,以备测量校正因子。
4.在低纸速下(如1cm∙min-1),进未知混合试样约1.4μL~2.0μL和空气20μL~40μL,各2~3次,记录色谱图上各峰的保留时间tR和死时间tM。
5.分别注射正已烷、苯、环已烷、甲苯等纯试剂0.2μL,各2~3次,记录色谱图上各峰的保留时间tR。
6.将记录仪纸速调快(如6cm∙min-1),每次进1.4μL~2.0μL已配制好的标准混合溶液2~3次,记录色谱图及各峰的保留时间tR。
7.在与操作6完全相同的条件下,每次进1.4μL~1.6μL未知混合试样,2~3次,记录色谱图及各峰的保留时间tR。
五、数据处理
1.用步骤6所得数据,计算前3个峰中,每两个峰间的分辨率。
2.比较步骤4和5所得色谱图及保留时间,指出未知混合试样中各色谱峰对应的物质。
3.用步骤6所得数据,以苯为基准物质,计算各组分的质量校正因子。
4.用步骤7所得色谱图,计算未知混合试样中各组分的质量分数。
六、问题讨论
1.本实验中,进样量是否需要非常准确?为什么?
2.将测得的质量校正因子与文献值比较。
3.试说明3种不同单位校正因子的关系和联系。
4.试根据混合试样各组分及固定液的性质,解释各组分的流出顺序。
|