一、实验目的
1.了解比色法测定配合物的组成和稳定常数测定的原理和方法。
2.学习分光光度计的使用及有关实验数据处理方法。
二、实验原理
磺基水杨酸与Fe3+离子可形成稳定的配合物。形成配合物时,其组成因pH不同而不同,当pH=2~3时,生成紫红色螯合物(有1个配位体);当pH值为4~9时,生成红色螯合物(有2个配位体);pH值为9~11.5时,生成黄色螯合物(有3个配位体);pH>12时,有色螯合物被破坏而生成Fe(OH)3沉淀。
如上所述,设中心离子和配体分别以M和L表示,且在给定条件下反应,只生成一种有色配离子MLn(略去电荷符号),反应式如下:
M十nL=MLn
若M和L都是无色的,而只有MLn有色,则此溶液的吸光度D与有色配合物的浓度c成正比。在此前提条件下,本实验用等物质的量连续变更法(也叫浓比递变法),即保持金属离子与配体总物质的量数不变的前提下,改变金属离子和配体的相对量,配制一系列溶液。显然在此系列溶液中,有些溶液中的金属离子是过量的,而另一些溶液中配体是过量的。在这两部分溶液中,配合物的浓度都不可能达到最大值,只有当溶液中金属离子与配体的物质的量数之比与配合物的组成一致时,配合物的浓度才能最大,因而吸光度最大,故可借测定系列溶液的吸光度,求该配合物的组成和稳定常数,测定方法如下:
配制一系列含有中心离子M和配体L的溶液,M和L的总物质的量相等,但各自的物质的量分数连续变更。例如,使溶液中L的物质的量分数依次为0、0.1、0.2、0.3……0.9、1.0,而M的物质的量依次作相应递减。然后在一定波长的单色光中,分别测定此系列溶液的吸光度。显然,有色配合物的浓度越大,溶液颜色越深,其吸光度越大。当M和L恰好全部形成配合物时(不考虑配合物的离解),MLn的浓度最大,吸光度也最大。
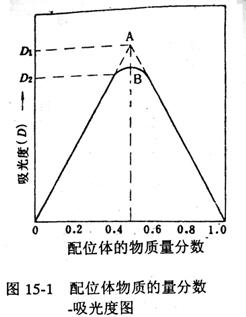
再以吸光度D为纵坐标,以配体的物质的量分数为横坐标作图,得一曲线(如图15-1所示),所得曲线出现一个高峰B点。将曲线两边的直线部分延长,相交于A点,A点即为最大吸收处。由A点的横坐标算出配合物中心离子与配体物质的量数之比,确定对应配位体的物质的量分数TL:

若TL=0.5,则中心离子的物质的量分数为1.0-0.5=0.5,所以:

由此可知,该配合物组成为ML型。
配合物的稳定常数也可根据图15-1求得。从图15-1可看出,对于ML型配合物,若它全部以ML形式存在,则其最大吸光度应在A处,即吸光度为D1,但由于配合物有一部分离解,其浓度要稍小些,所以,实测得的最大吸光度在B处,即吸光度D2。显然配合物离解越大,则D1-D2差值越大,因此配合物的离解度α为:
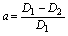
配离子(或配合物)的表观稳定常数K与离解度α的关系如下:
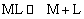
起始浓度/mol·dm-3
c 0 0
平衡浓度/ mol·dm-3
c-ca ca ca
 稳(表观)
稳(表观)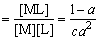
式中,c表示B点所对应配离子的浓度。也可看成溶液中金属离子的原始浓度。
本实验是在pH值为2~3的条件下,测定磺基水杨酸铁(Ⅲ)组成和稳定常数,并用高氯酸来控制溶液的pH值,其优点主要是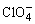 不易与金属离子配合。
不易与金属离子配合。
在不同pH条件下,不同电解质lga值不同。在pH=2时,磺基水杨酸的lga=10.297,即:
K稳=K稳(表观)·1010.297
三、仪器和药品
仪器:
刻度试管器(10cm3 11支);移液管5cm3 2支;容量瓶(50cm3 2个);容量瓶(25cm3 2支);洗耳球;擦镜纸;滤纸碎片;坐标纸;7220型分光光度计;滴管。
药品:
高氯酸HClO4(0.01mol·dm-3,将4.4cm3 70%HClO4加到50cm3水中,稀释到5000cm3;硫酸高铁铵(NH4)Fe(SO4)2
0.0100mol·dm-3,将称准的分析纯硫酸高铁铵(NH4)Fe(SO4)2·12H2O结晶溶于0.01 mol·dm-3
HClO4中配制而成);磺基水杨酸0.0100 mol·dm-3,将称准的分析纯磺基水杨酸溶于0.01 mol·dm-3中配制而成。
四、实验内容
1.溶液的配制
(1)配制0.00100 mol·dm-3
Fe3+溶液:用移液管吸取5.00cm3 0.0100 mol·dm-3
(NH4)Fe(SO4)2溶液,注入50cm3容量瓶中,用0.0100 mol·dm-3HCl04溶液稀释至刻度,摇匀备用。
(2)配制0.00100 mol·dm-3磺基水杨酸溶液:用吸液管准确吸取5.00)cm3
0.0100 mol·dm-3磺基水杨酸溶液注入25cm3容量瓶中,用0.01 mol·dm-3
HClO4溶液稀释至刻度,摇匀备用。
2.连续变更法测定有色配离子(或配合物)的吸光度
(1)用2支5cm3移液管按表15-1的数量取各溶液,分别放入已编号的洗净且干燥的11支10cm3刻度试管器中,用0.01 mol·dm-3的HClO4稀释至刻度,使总体积为10cm3,摇匀各溶液。
(2)接通分光光度计电源,并调整好仪器,选定波长为500mm的光源(分光光度计的使用方法参看P23)。
(3)取4只厚度为lcm的比色皿,往其中一只中加入约比色皿3/4体积的参比溶液(用0.0lmol·dm-3
HClO4溶液或表15-1中的11号溶液),放在比色架中的第一格内,其余3只依次分别加入各编号的待测溶液。分别测定各待测溶液的吸光度,并记录之。
表15-1
|
溶液编号
|
0.00100 mol·dm-3
Fe3+的体积VM/cm3
|
0.00100 mol·dm-3
磺基水杨酸的体积
VL/cm3
|
磺基水杨酸物质的量分数
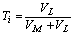
|
吸光度D
|
|
(1)
|
5.00
|
0.00
|
|
|
|
(2)
|
4.50
|
0.50
|
|
|
|
(3)
|
4.00
|
1.00
|
|
|
|
(4)
|
3.50
|
1.50
|
|
|
|
(5)
|
3.00
|
2.00
|
|
|
|
(6)
|
2.50
|
2.50
|
|
|
|
(7)
|
2.00
|
3.00
|
|
|
|
(8)
|
1.50
|
3.50
|
|
|
|
(9)
|
1.00
|
4.00
|
|
|
|
(10)
|
0.50
|
4.50
|
|
|
|
(11)
|
0.00
|
5.00
|
|
|
五、数据处理
1.作图
以配合物吸光度D为纵坐标,磺基水杨酸的物质的量分数或体积分数为横坐标作图(图15-1)。从图中找出最大吸光度。
2.计算
由配位体物质的量分数-吸光度图,找出最大吸收处,并算出磺基水杨酸铁(Ⅲ)配离子的组成和表观稳定常数。
六、思考题
1.本实验测定配合物的组成及稳定常数的原理是什么?
2.连续变更法的原理是什么?如何用作图法来计算配合物的组成和稳定常数。
3.连续变更法测定配离子组成时,为什么说溶液中金属离子与配体物质的量之比恰好与配离子组成相同时,配离子的浓度最大?
4.使用比色皿时,操作上有哪些应注意的?
5.本实验为何选用500nm波长的光源来测定溶液的吸光度,在使用分光光度计时应注意哪些事项?