|
一、实验目的
1.测定乙酸乙酯的皂化反应速率常数,了解反应活化能的测定方法。
2.了解二级反应的特点,学会用图解计算法求出二级反应的反应速率常数。
3.熟悉电导仪的使用。
二、实验原理
乙酸乙酯皂化反应是典型的二级反应
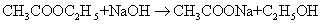
t=0
c
c
0
0
t=t时
c-x c-x
x
x
 时
0
0 时
0
0
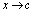 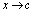
时间为t的反应速度和反应物浓度的关系为
 (11-1) (11-1)
式中:k为反应速率常数。将上式积分可得:
 (11-2) (11-2)
从式(11-2)中可看出,原始浓度c是已知的,只要测出t时的x值,就可算出反应速度常数k值。首先假定整个反应体系是在稀释的水溶液中进行的,则溶液中电解质的浓度与其电导G成正比。
用电导法测定x的依据:
(1)此溶液的电导主要是强电解质NaOH、CH3COONa所贡献,即OH-、Na+、CH3COO-(水电离的H+可以忽略),在反应前后,Na+浓度不变,OH-浓度不断减少,CH3COO-浓度相应增加,而OH-比CH3COO-的摩尔电导率大得多,所以溶液的电导总趋势为下降。
(2)在稀溶液中,每种离子的电导与其浓度成正比,而且溶液的总电导等于组成溶液的各离子的电导之和。
对于乙酸乙酯的皂化反应来说,当反应开始时,只有Na+和OH-,所以开始时电导G0。
t=0时 G0=A1c (11-3)
当反应进行到全部生成CH3COONa和H2O时(此为一种假想状态),只有Na+和CH3COO-,所以假想态电导G∞:
t=“∞”时 G∞=A2c
(11-4)
其中A1、A2为与温度、溶剂、电解质有关的常数,当反应进行到t时刻时,此时CH3COONa浓度为x,NaOH的浓度为c-x,则此时的总电导Gt:
t时 Gt=A2x+A1(c-x)
(11-5)
式(11-3)和式(11-4)代入式(11-5)得
 (11-6) (11-6)
将式(11-6)代入式(11-2)得
 (11-7) (11-7)
整理式(11-7)得
 (11-8) (11-8)
以Gt对 作图,可得一直线,其斜率等于 作图,可得一直线,其斜率等于 ,由此可得反应速率常数k。 ,由此可得反应速率常数k。
一般地,反应速率常数k与反应温度T之间服从阿仑尼乌斯方程。即
 (11-9a) (11-9a)
或 (11-9b) (11-9b)
式中Ea为此反应表观现活化能,C为积分常数。
显然,在不同的反应温度下测定其反应速率常数k,作出lnk对1/T图,应得一条直线,其斜率为-Ea/R,可以算出反应表现活化能Ea。
三、仪器和试剂
恒温槽(或超级恒温器) 1套
双管皂化池
1个
锥形瓶
秒表
1只
容量瓶
乙酸乙酯(A.R.)
小滴瓶
NaOH(应无Na2CO3、NaCl等杂质)
电导仪(或电导率仪)
1套
电导水(或重蒸馏水)
移液管(20cm3)
3支
四、操作步骤
1.了解和熟悉电导仪的构造和使用注意事项(参见精密仪器部分十二)。
2.配制0.0200mol·dm-3的NaOH和0.0200mol·dm-3 CH3COOC2H5溶液。
乙酸乙酯溶液配制方法:先算出l00cm3 0.0200 mol·dm-3
CH3COOC2H5中溶质的质量,在l00cm3的容量瓶中加入少量的电导水,准确称其质量,然后用小滴瓶滴入10滴乙酸乙酯,摇匀后称其质量,计算出每一滴乙酸乙酯的质量,然后算出0.0200mol·dm-3乙酸乙酯所需加入乙酸乙酯的滴数,用控制滴数方法加入接近所需加入乙酸乙酯的量,摇匀后称其质量,最后几滴应特别小心,为避免因最后一滴的滴入而使加入的量超过其需质量,可采用滴管口刚刚接触滴瓶中的液面而吸入液体的方法,此时吸入液体一般少于一滴,然后滴入容量瓶中,称量乙酸乙酯的量与理论计算的量不得超过1毫克。
氢氧化钠的配制:先称NaOH配制0.1mol·dm-3的NaOH溶液,用基准试剂标定其浓度,计算0.0200 mol·dm-3
NaOH溶液100cm3所需预先配制的NaOH的体积,用移液管吸入其量加入100cm3的容量瓶中,用电导水定容。
3.G0的测定
将0.0200 mol·dm-3的NaOH稀释成0.0100 mol·dm-3的NaOH,装入干燥的100cm3的具塞瓶中;调节超级恒温器使水温为20℃,使0.0100 mol·dm-3的NaOH恒温10分钟;插入铂黑电导池电极,液面应至少高出铂黑片1cm,然后接通电导仪,测定电导,记录电导数值。(注意此时指针位置应调整到接近满刻度一端,同时在测Gt时,电导率仪不能再重新调整)。然后取出铂黑电极,其0.0100 mol·dm-3的NaOH盖上塞子,备下一次使用。
4.Gt的测定
将干燥、洁净的双管皂化池放在恒温槽中并夹好,用移液管取20cm3 0.02mol·dm-3的NaOH溶液放入A管,用另一支移液管取20cm3 0.02 mol·dm-3的乙酸乙酯溶液放入B管,塞好塞子,以防挥发。将铂黑电极经重蒸馏水洗后,用滤纸小心吸干电极上的水(千万不要碰到电极上的铂黑),然后将电极插入A管,恒温10分钟,打开B管塞子,用洗耳球通过B管上口将乙酸乙酯溶液迅速压入A管(此时A管不要塞紧,不要用力过猛使溶液溅出),与NaOH溶液混合,当乙酸乙酯压入一半时开始记时间,反复压几次即可混合均匀。开始每分钟读一次数据,十分钟后每二分钟读一次数据。
5.将皂化池洗净,用电吹风吹干,按(3)、(4)步骤进行测定25℃、30℃、35℃、40℃的G0、Gt之值。
实验完后,将铂黑电极用蒸馏水洗净,并装入盛有蒸馏水的试管中。
五、数据记录和处理
1.数据记录于下表中
室温t℃=
气压p=
起始浓度c/mol·m-3=
|
实验温度=
|
G0=
|
|
时间t/min |
|
|
|
|
|
|
|
|
|
|
|
Gt/S |
|
|
|
|
|
|
|
|
|
|
|
(G0-Gt)/t/S·min-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.作Gt-t图。
3.由Gt-t图外推至t=0处,可求得G0,与测得的G0比较并简单讨论之。
4.作Gt~(G0—Gt)/t图,由直线的斜率求出相应温度下的k值。
5.lgk~1/T图,由直线斜率求出活化能。
六、思考讨论题
1.配制乙酸乙酯溶液时,为什么在容量瓶中要事先加入适量的蒸馏水?
2.为什么0.02mol·dm-3的NaOH稀释一倍后的电导就可认为是G0?仿此怎样确定 ? ?
3.测定G0时,指针应接近满刻度为宜,为什么?若不是此情况,怎么办?道理何在?
4.为什么要使两种反应物浓度相等?若起始浓度不同时,应如何计算k值?
|