|
一、实验目的
测量铜-锌原电池的电动势,计算反应的热力学函数。了解电动势的测量原理和方法。
二、实验原理
电池反应中,摩尔吉布斯函数[变]、摩尔熵[变],反应热分别为
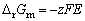 (1) (1)
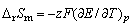 (2) (2)
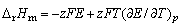 (3) (3)
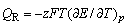 (4) (4)
可见,只要测出某一电池反应的电动势E及其温度系数(∂E/∂T),,就可算出热力学函数。
可逆电池的电动势数据可用于热力学计算。可逆电池电动势的测量条件除了电池反应可逆和传质可逆外,还要求在测量回路中电流趋近于零。测定电动势不能用伏特计。因为电池与伏特计相接后会有电流通过,电池中电极被极化,电解液组成也会发生变化。所以伏特计只能测得电池电极间的电势降,而不是平衡时的电动势。利用对消法可使我们在测量回路中电流趋于零的条件下进行测量,所测得的结果即为可逆电池的电动势。对消法电路如图8-1所示。acBa回路由工作电源、可变电阻和电位差计组成。工作电源的输出电压必须大于待测电池的电动势。调节可变电阻使流过回路的电流为某一定值,在电位差计的滑线电阻上产生确定的电势降,其数值由已知电动势的标准电池Es校准。另一回路abGExa由待测电池Ex、检流计G和电位差计组成。移动b点,当回路中无电流通过时.电池的电动势等于a、b两点的电势差。对消法测电动势是一个接近热力学可逆过程的例子。为了尽可能减小电池中溶液接界外因扩散产生的非平衡液接电势,两电极间用盐桥连通。
三、仪器试剂
直流电势差计一台;光点反射检流计一台;标准电池一个;于电池(1.5V)两节;铜电极、锌电极(带电极池)各一支;超级恒温器一台;0.100mol·dm-3硫酸铜和硫酸锌溶液若干;饱和氯化钾溶液;2.00mol·dm-3硫酸溶液;6.00 mol·dm-3硝酸溶液;丙酮试剂(A.R.);小烧杯;金相砂纸。
四、实验步骤
先对电极进行预处理。用金相砂纸把电极片抛光,用水冲洗后在丙酮液中浸洗数分钟,再用稀硫酸和稀硝酸浸洗。然后将电极用蒸馏水冲洗于净。分别用硫酸铜溶液和硫酸锌溶液冲洗铜电极和锌电极各三次(若作精确测定,则对锌电极要进行汞齐化处理,铜电极要进行电镀处理)。处理好电极后,按图8-2组装好电池并置于恒温器中。组装电池时要特别注意电池导液管中不能有气泡。然后分别在两个选择的温度(可选25℃和35℃)下测电动势。两个温度下电动势之差除以温差,可得到较为满意的温度系数(∂E/∂T)p,的近似值。若作精确测量,可测出多个温度时的E值;以E对T作图,可得一条曲线,曲线上某点的斜率即为该温度下的(∂E/∂T)p值。测电动势时,每个值均需测三次,取平均值。
电位差计、标准电池的使用见仪器设备部分。
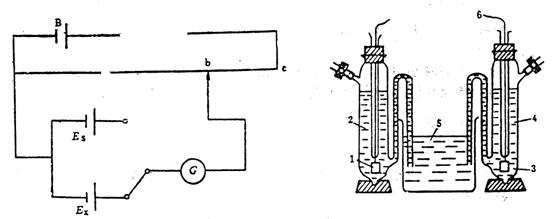
图8-1 对消法原理线路图
图8-2 Zn-Cu原电池
1-Zn电极;2-ZnSO4溶液;(C1);3-Cu电极;
4-CuSO4溶液(C2);5-饱和KCl溶液;6-接电位差计
五、数据处理
由25℃时的E值和(∂E/∂T)p,值分别计算 (298K)、 (298K)、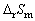 (298K)、 (298K)、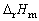 (298K)和QR。 (298K)和QR。
六、思考题
1.测量中若检流计光点总往一边偏转,可能是什么原因?
2.利用已有数据能否计算铜离子和锌离子的平均活度系数?
|