|
一、实验目的
1.了解测定电极电势的原理与方法。
2.掌握用酸度计测定原电池电动势的方法。
3.了解原电池、电解池的装置及其作用原理。
4.观察金属腐蚀现象,了解金属电化学腐蚀的基本原理。
5.了解几种防护金属腐蚀的原理和方法。
二、实验原理
1.电极电势和原电池电动势的测定
电极电势是由某电对以标准氢电极为基准而得出的相对平衡电势,若欲测量是某一电对的电极电势,是将该电对组成的电极与标准氢电极构成一原电池,测量该原电池的电动势。由于原电池的电动势与电极电势有如下关系:
E=E++E-
而标准氢电极的电极电势规定为零,因此根据测量得到的电动势和上式,就可以求出该电对在相应条件下的电极电势,然后利用能斯特方程式
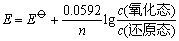
就可以求得该电对的标准电极电势。
原电池电动势不能用伏特计直接测量。因为用伏特计测量时,有电流通过测量电池,这样会给测量带来较大的误差,因此只有当被测电池的电路中几乎没有电流通过时,才能准确测量原电池的电动势。要做到这一点,通常是采用补偿法进行测量,也可以用电子管伏特计测量。本实验用酸度计的毫伏档(相当于电子管伏特计)测量原电池的电动势。
在实际测量电极电势的工作中,由于标准氢电极控制的条件很严,使用不太方便,因此常用电势稳定的甘汞电极(当KCl为饱和溶液,温度为298K时,其电势值为0.2415V)为参比电极,以代替标准氢电极。
测定锌电极的电极电势时,可以将锌电极与甘汞电极组成原电池,测出该原电池的电动势E,即能求出锌电极的电极电势:

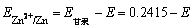
2.把二种不同金属分别浸入其盐溶液中,再用导线和盐桥依次将它们连接起来,就组成原,电池(丹尼尔电池)。将原电池两极上的导线插人盛有电解质溶液(如NaC1的容器中,就组成了电解池。与原电池负极相连的极是电解池的阴极,与原电池正极相连的极是电解池的阳极。当电流通过电解池时,除电解质的离子可能放电外,水中的H+离子和OH-离子也可能放电,如电极为一般金属,阳极金属会溶解。
电化学腐蚀是金属在电解质溶液中发生电池的作用而引起的一种腐蚀。这种原电池称为腐蚀电池。电极电势较低的金属为腐蚀电池的阳极,发生氧化过程而溶解于电解质溶液中而腐蚀,腐蚀电他的萌极被保护,同时在阴极上发生析氢或吸氧的还原过程。
利用指示剂所发生的颜色变化,即可判断腐蚀电池中阳极区和阴极区的位置。
阳极区: Fe
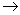 Fe2+ +
2e Fe2+ +
2e
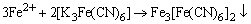 (蓝色) (蓝色)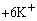
阴极区:
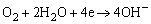
OH- + 酚酞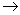 变红 变红
若金属处于中性溶液时,如果溶剂中有溶解氧,则大多数情况下发生氧去极化腐蚀(3),此时氧浓度较低的区域,电极电位较低,成为阳极。
防护金属腐蚀的方法很多。本实验采用缓蚀剂法和化学氧化膜法。在腐蚀介质中加入很少量能使金属腐蚀速度大大减慢的物质叫缓蚀剂。缓蚀剂的作用实质上在于使电化学的阳极过程或阴极过程减慢,从而减慢金属的腐蚀。
钢铁表面经化学氧化外理后,生成一层均匀面稳定的氧化膜呈现兰黑色。故叫“发兰”。其反应如下:
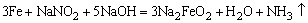
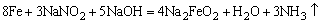
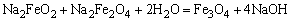
这种方法也叫发兰法。发兰既能防锈,又增加美观,且由于氧化膜层较薄,不影响零件的精密度。
钢铁表面在一定条件下,经磷酸盐水溶液处理后,表面上能形成一层磷酸盐保护膜,即磷化膜,此膜能耐腐蚀、绝缘性好、疏松多孔、附着力强的性质。(方法见实验三十)
三、仪器与药品
(1)仪器
烧杯(10cm3三个)、井穴板、试管、试管架、坩蜗、表面皿、盐桥、导线(带Zn片和Cu片)、砂纸、温度计、酸度计、甘汞电极
(2)药品
盐酸(1mol·dm-3)、硫酸(20%含缓蚀剂)、硫酸铜(0.5、0.1mol·dm-3,3%),硫酸锌(0.5、0.1mol·dm-3)、铜试剂(0.1mol·dm-3)、酚酞(1%)、琼胶溶液(300cm3水中加入lg琼胶加热溶解)、K3[Fe(CN)6)(0.1mol·dm-3)、20%六次甲基四胺(乌洛托品)、小铁钉、铁丝、粗铜丝、纯锌粒、锌片。
四、实验内容
1.Zn2+/Zn电极电势测定
取两只干燥的10ml烧杯,在一个烧杯中加入4m1 0.1mol·dm-3 ZnSO4溶液,将锌电极插入到ZnSO4溶液中,另一个烧杯中加入4ml饱和KCl溶液,插入饱和甘汞电极,用盐桥将两个烧杯中的溶液连通起来,组成原电池(装置见图7-1)
将准备好的待测电池的两极分别与调试好的酸度计的两极联接,然后按酸度计电极电势测定法测量待测电池的电动势。根据测得的电动势,计算锌电极在0.10mol·dm-3 ZnSO4溶液中的电极电势,并利用能斯特方程式推导出锌电极的标准电极电势。
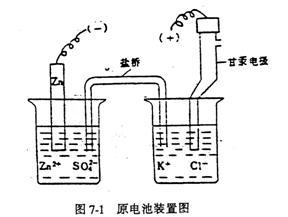
(-)Zn/ZnSO4(0.10mol·L-1)//饱和KC1,Hg2Cl2/Hg,Pt(+)
做完实验后,把饱和KCl倒回原试剂瓶,将ZnSO4、CuSO4溶液留做下面实验2中的(1)和(3)。
2.(1)原电池和电解池(如图7-2)
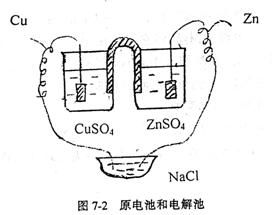
取二只10cm3烧杯分别注入约4cm3 0.1mol·dm-3
CuSO4和0.1mol·dm-3 ZnSO4溶液,然后按图7-2装置好。在电解池中加入约5cm3 0.5mol·dm-3
NaCl及二滴酚酞指示剂,待数分钟后观察电解池中电极附近有何现象。然后滴加铜试剂,有何现象。
根据实验结果,试判断原电池的正负极和电解池的阴阳极。
注意:做完实验后,CuSO4和ZnSO4溶液按实验3的装置倒入6孔井穴板。
(2)原电池为电源电解KI溶液
取一块六孔井穴板,按图7-3装置,在1#、2#、4#、5#四个井穴板中分别用4cm3 0.1mol·dm-3
ZnSO4和4cm3 0.1mol·dm-3
CuSO4配成二个铜锌原电池,并将二个原电池串联起来。
在6#井穴板中加入3cm3 0.1mol·dm-3
KI、3滴淀粉溶液和1滴酚酞溶液。搅拌均匀后,插入二段玻璃管。一段玻璃管内插入一根表面涂锡的铜丝,并与原电池的正极相接,构成阳极;另一段玻璃管内插入一根铜丝,并与原电池的负极相接,构成阴极。(阴极和阳极不要插入溶液太深)注意观察电解池内两电极周围溶液的颜色变化。写出电极反应和电解反应方程式。
3.金属的腐蚀
(1)在九孔井穴板的两个井穴中,各加入0.5cm3 1mol·dm-3
HC1,然后分别放入一粒大小相近的纯锌和粗锌,观察气泡产生情况,比较它们腐蚀速度快慢。再向放纯锌的井穴中滴加两滴0.5mol·dm-3 CuSO4,有何现象?(或取一根细铜丝,与纯锌接触,观察接触前后有何不同。)解释实验现象。
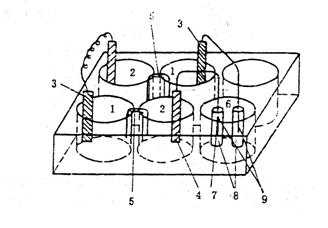
图7-3 以原电池作电源电解KI溶液的装置
1-ZnSO4;2-CuSO4;3-锌片;4-铜片;5-盐桥;6-KI;7-表面涂锡的钢丝;8-玻璃管;9-铜丝
(2)取一根小铁丝,用砂纸擦去锈层,然后用2 mol·dm-3
HCl酸洗,并缠在锌片上,再取一小铁钉,也按以上手续除去锈,并缠上铜丝,将它们放在同一个表面皿上,切勿接触。
另取琼胶热溶液,并加几滴酚酞和0.1 mol·dm-3
K3[Fe(CN)6]溶液。搅匀后倒在表面皿上,使Fe-Zn和Fe-Cu全部盖满,约30分钟,观察现象。
根据实验结果,判断哪种金属被腐蚀。
(3)取一小钢片用砂纸擦去锈层,分别滴上一滴0.5 mol·dm-3
NaCl、0.1 mol·dm-3 K3[Fe(CN)6)及酚酞溶液,静放10分钟后,观察液滴周围和中央出现什么现象,解释之。
4.金属腐蚀的防护
(1)缓蚀剂法:
六孔井穴板的两个井穴中,各放入两枚已去锈的小铁钉,并向其中的一个井穴中加5滴20%六次甲基四胺,然后各加入2cm3 1 mol·dm-3
HCl。2min后各加1滴0.1mol·dm-3
K3[Fe(CN)6]溶液,观察、比较两个井穴中所呈现颜色的深浅。为什么?
(2)阴极积护法:
将一条滤纸片放在表面皿上,并用酚酞-K3[Fe(CN)6]-NaCl腐蚀液润湿之;取两枚铁钉隔开一段距离放置在这润湿的滤纸上,并分别与铜锌电池(自己组装)的正、负极相连。静置一段时间后,观察有何现象,写出相应反应式,并解释之。
5.摇摆反应(选做)
在小烧杯中先加入10ml l2.3%H2O2溶液,然后再同时加等体积的0.2 mol·dm-3的酸性KIO3溶液和丙二酸-MnSO4-淀粉混合液(调至22~23℃);观察溶液颜色的变化。说明H2O2在反应中的作用。
五、思考题
1.如何用酸度计测量原电池的电动势?
2.如果没有电表,你将如何用简便的方法辨认原电池的正负极?
3.电化学腐蚀的基本原理是什么?何谓析氢腐蚀和吸氧腐蚀?
4.电化学腐蚀与化学腐蚀哪种危害性更大?为什么?
5.氧浓差电池腐蚀的根据是什么?你能举出这类腐蚀的1-2个实例吗?
6.金属腐蚀的防护方法(除实验中方法外)还有哪些?
|