|
一、实验目的
(1)试验弱电解质的电离平衡及其移动。
(2)配制缓冲溶液并试验其性质。
(3)观察盐的水解和水解平衡的移动。
(4)试验沉淀的生成、溶解和相互转化条件,进一步掌握难溶电解质的多相离子平衡的溶度积规则。
二、实验原理
(1)在弱电解质的溶液中加入含有共同离子的另一强电解质,可使弱电解质的电离度减小;在难溶电解质的饱和溶液中加入含有共同离子的其他强电解质时,其溶解度减小,这种效应叫同离子效应。
(2)弱酸和它的盐或弱碱和它的盐所组成的混合溶液,具有缓冲作用,当外加少量强酸或少量强碱或稀释时,溶液的pH值变化不大,具有上述性质的溶液叫缓冲溶液。缓冲溶液的pH值计算公式为:
pH=pKa+lg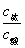 (c盐、c酸较大) (c盐、c酸较大)
可见缓冲溶液的pH值主要决定于pKa,且与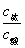 的大小有关。 的大小有关。
根据上式,可以配制出所需要的缓冲溶液。
(3)盐类的水解反应是由组成盐的离子和水电离出来的H+或OH-离子作用;生成弱酸或弱碱的过程。水解后溶液的酸碱性取决于盐的类型;水解反应是吸热反应并有平衡存在,因此温度升高,有利于水解的进行。
有些盐水解后的产物溶解度很小,生成沉淀,如SbCl3,存在SbCl3+H2O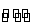 SbOCl(S)+2HCl产生的SbOCl白沉是Sb(OH)2Cl脱H2O后的产物,加入HCl则上述平衡向左移动。故实验室配制SbCl3溶液时,要先加入一定浓度的盐酸防止其水解。 SbOCl(S)+2HCl产生的SbOCl白沉是Sb(OH)2Cl脱H2O后的产物,加入HCl则上述平衡向左移动。故实验室配制SbCl3溶液时,要先加入一定浓度的盐酸防止其水解。
两种都能水解的盐,若水解后一种溶液呈酸性,另一种溶液呈碱性,当这两种盐溶液相混合时,彼此可以加剧水解,如:将Al2(SO4)3溶液和Na2CO3溶液混合,水解反应较剧烈。
2Al3++3CO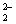 +3H2O=2Al(OH)3(S)+3CO2↑ +3H2O=2Al(OH)3(S)+3CO2↑
(4)难溶电解质溶液的多相离子平衡,有溶度积规则。例如,在Ag2CrO4的饱和溶液中,存在如下的平衡:
Ag2CrO4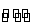 2Ag++CrO 2Ag++CrO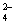
温度一定时,有Ksp(Ag2CrO4)=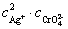 即在难溶电解质的饱和溶液中,当温度一定时,难溶电解质离子浓度幂的乘积是一个常数,叫溶度积。根据溶度积可判断沉淀的生成和溶解,溶度积规则为: 即在难溶电解质的饱和溶液中,当温度一定时,难溶电解质离子浓度幂的乘积是一个常数,叫溶度积。根据溶度积可判断沉淀的生成和溶解,溶度积规则为:
Qi(离子积)>Ksp 则有沉淀析出或溶液过饱和
Qi=Ksp 饱和溶液
Qi< Ksp
溶液未饱和,无沉淀析出或沉淀溶解
(5)如果溶液中同时含有数种离子,当逐步加入某种试剂,由于生成的几种难溶电解质的溶度积大小不同,而分先后次序沉淀的现象称为分步沉淀。其中若某种难溶电解质的离子积先达到其溶度积,这时该难溶电解质先沉淀,反之,后沉淀。
使一种难溶电解质转化为另一种难溶电解质的过程称为沉淀的转化。例如硫酸铜溶液和闪锌矿(ZnS)的反应,可使闪锌矿转化为蓝铜矿(CuS):
CuSO4+ZnS(S)=CuS(S)+ZnSO4
一般溶解度大的难溶电解质容易转化为溶解度小的难溶电解质。不同类型的难溶电解质不能直接用溶度积比较,而应换算为溶解度,溶解度越小则电解质越难溶。
三、仪器和药品
(1)仪器:9孔井穴板;酒精灯;玻棒;牛角匙;量筒(10cm3);洗瓶;10cm3小烧杯;一支试管;试管夹。
(2)药品:
|
HCl(浓0.1、0.2 mol·dm-3)
|
HAc(0.1、0.2
mol·dm-3)
|
|
NaOH(0.1 mol·dm-3)
|
NH3·H2O(0.1、2 mol·dm-3)
|
|
AgNO3(0.1
mol·dm-3)
|
Al2(SO4)3(饱和溶液)
|
|
CuSO4(0.1
mol·dm-3)
|
K2CrO4(0.1mol·dm-3)
|
|
MgCl2(0.1
mol·dm-3)
|
NaAc(S、0.2mol·dm-3)
|
|
NaCl(0.1 mol·dm-3)
|
Na2S(0.1mol·dm-3)
|
|
Na2CO3(饱和溶液)
|
PbCl2(饱和溶液)
|
|
NH4Cl(S、1
mol·dm-3)
|
Pb(NO3)2(0.1mol·dm-3)
|
|
SbCl3
(0.1 mol·dm-3)
|
Zn(NO3)2(0.1mol·dm-3)
|
|
精密pH试纸
|
|
|
酚酞0.1% 甲基橙0.1%
|
|
四、实验内容
1.同离子效应
(1)取几滴0.1 mol·dm-3
HAc,加一滴甲基橙,观察颜色,然后加少量NaAc固体,比较颜色变化,说明原因。
(2)取几滴0.1 mol·dm-3
NH3·H2O,加一滴酚酞,观察溶液颜色,然后加少量NH4Cl固体,比较颜色变化,说明原因。
(3)加几滴饱和PbCl2溶液于井穴板的一干燥孔中,然后再加入1~2滴浓HCl,有何现象?说明原因。
2.缓冲溶液的配制和性质
(1)欲配制pH=4.1的缓冲溶液10cm3,用0.2 mol·dm-3
HAc和0.2 mol·dm-3 NaAc溶液如何配制?配制好缓冲溶液后用pH试纸检验其pH值。(保留该缓冲溶液以供下用)。
(2)将上配制好的缓冲溶液分三份装入井穴板的三个孔中,分别加0.1 mol·dm-3 HCl、0.1 mol·dm-3
NaOH、10滴去离子水搅拌,分别用精密pH试纸检验其pH值。然后将上述的缓冲液换成同样体积的去离子水,再各加1滴0.1 mol·dm-3
HCl、0.1mol·dm-3 NaOH、10滴去离子水,分别用精密pH试纸检验,比较pH值的变化?解释原因。
3.盐类的水解
(1)温度对水解的影响:在试管中加20滴0.2 mol·dm-3
NaAc和一滴酚酞指示剂,记录溶液的颜色,再将试管加热近沸,观察其溶液颜色的变化。冷却后,再观察溶液颜色的变化?解释之,并写出NaAc水解方程式。
(2)浓度对水解的影响:取5滴去离子水,向里加1滴SbCl3(0.1
mol·dm-3),摇匀,有何现象?再向里加浓HCl至溶液变澄清为止,再加水稀释,又有何变化?写出SbCl3水解反应式,并解释上述实验现象,说明在配SbCl3溶液时应注意什么?
(3)能水解的盐类向的相互反应:用pH试纸测定饱和Al2(SO4)3和饱和Na2CO3溶液的酸碱性,然后分别取3滴饱和Al2(SO4)3和6滴Na2CO3饱和液于井穴板的一孔中,观察现象。写出水解反应式,并解释原因。
4.溶度积规则的应用
(1)沉淀的生成和溶解
A.分别取3滴0.1 mol·dm-3
AgNO3溶液和2滴K2CrO4(0.1 mol·dm-3)溶液于井穴板的一孔中,观察现象,写出反应方程式。同上操作,用Pb(NO3)2(0.1
mol·dm-3)代替AgNO3溶液,又有何现象?用溶度积规则解释。
B.在井穴板一孔中,加0.10 mol·dm-3 MgCl2
2滴,逐滴加NH3·H2O(2mol·dm-3),至生成沉淀止,记录沉淀颜色,再向里加NH4Cl(1
mol·dm-3)数滴,观察沉淀是否溶解?解释上述现象。
C.同上取0.1 mol·dm-3
Zn(NO3)2 5滴,加1滴0.1 mol·dm-3
Na2S,观察沉淀的生成和颜色,再向里加2 mol·dm-3 HCl数滴,观察沉淀是否溶解,试解释之。
(2)分步沉淀:取1滴AgNO3(0.1
mol·dm-3)和3滴Pb(NO3)2于试管中,加3cm3去离子水稀释,摇匀,然后逐滴加0.1 mol·dm-3
K2CrO4,并不断搅拌,观察沉淀的颜色。继续滴加K2CrO4溶液,沉淀颜色有何变化?根据沉淀颜色变化和溶度积计算,判断沉淀生成的先后次序。
(3)沉淀转化:
A,取2滴0.1 mol·dm-3
AgNO3,加5滴0.1 mol·dm-3 K2CrO4,搅拌,观察沉淀的颜色。再加0.1 mol·dm-3
NaCl 5滴,搅拌,观察沉淀的颜色变化,解释现象并写出反应方程式。
B.取0.1 mol·dm-3
Zn(NO3)2 溶液3滴,加0.1 mol·dm-3
Na2S,观察沉淀的生成,然后逐滴加0.1 mol·dm-3 CuSO4溶液,并搅拌,观察沉淀颜色的变化?运用溶度积规则解释肋转化成CuS的原因,并写出反应方程式。
五、思考题
1.什么叫同离子效应?其对弱电解质电离度和难溶电解质溶解度各有什么影响?
2.什么叫缓冲溶液,如何配制和计算缓冲溶液的pH值?缓冲溶液有何性质?
3.盐类的水解是怎样产生的?其溶液的pH值如何计算?影响水解反应的因素有哪些?
4.实验室如何用固体SbCl3配制成所需浓度的溶液?
5.何谓溶度积?怎样用溶度积规则判断难溶电解质的生成和溶解?分步沉淀和沉淀转化有何区别?本实验是如何来验证的?
|