一、实验目的
(1)了解配合物生成以及配离子与简单离子的区别。
(2)了解配位平衡与沉淀平衡的相互转化规律。
二、实验原理
(1)配位化学是无机化学的重要分支,配合物的合成和研究是无机化学最活跃的领域之一。配合物是用途广泛的一类重要化合物,配合物是含有配离子的盐:,面配离子是以中心离子和若干配体(阴离子或中性分子)以配位键相结合形成的复杂离子,配离子可带正电荷或负电荷。
本实验中制备两个配合物:
[Cu(NH3)4SO4·H2O]
K3[Fe(SCN)6]
方括号内表示配离子,它是中心离子和配位体组成的整体,即配位体直接与中心离子键合,称为配合物的内界,而方括号以外的部分称为配合物的外界。
配合物与复盐不同。在水溶液中,配合物离解出来的配离子很稳定,只有很少部分电离成简单离子或粒子(中心离子或配位体),而复盐则几乎全部电离为简单离子。例如:
复盐 (NH4)2Fe(SO4)2→2NH4+Fe2+2SO4
配合物 [Cu(NH3)4]SO4→[Cu(NH3)4]2++SO4
[Cu(NH3)42+Cu2++4NH3
一般情况下,副族元素易形成配位化合物。例如:Zn2+、Cu2+、Ag+、等离子均易与氨水形成相应的配离子[Zn(NH3)4]2+
、[Cu(NH3)4]2+、[Ag(NH3)2]+等。配离子在溶液中存在着离解平衡,例如:
[Ag(NH3)2]
+(aq) →Ag+ (aq)+2NH3(aq)
其离解常数为:
K不稳=[Ag+]·[NH3]2/[Ag(NH3)2+]
K不稳称为不稳定常数,可表示该配离子在水溶液中的不稳定程度。K稳称为稳定常数,是K不稳的倒数,它可表示该配离子在水溶液中的稳定程度。
应当指出,Fe3+和Cr3+与氨水溶液反应生成的产物不是配离子,而是相应的氢氧化物沉淀Fe(0H)3和Cr(OH)3。氨水与不同金属离子生成不同产物的情况,可作为分离金属离子的一种依据。
配离子的离解平衡也是一种离子平衡,它能向着生成更难离解或更难溶解物质的方向移动。例如,配离子[Ag(NH3)2]+因加入不同的沉淀剂或配合剂(或控制不同浓度)而经历一系列的沉淀和溶解的相互转化,又如:[Fe(SCN)n]3-n比FeCl 更难离解,所以[FeCl
更难离解,所以[FeCl ]-水溶液中可向生成[Fe(SCN)n] 3-n方向移动。其反应方程式:
]-水溶液中可向生成[Fe(SCN)n] 3-n方向移动。其反应方程式:
[FeCl ]-+nSCN→[Fe(SCN)n]3-n+4C1-
]-+nSCN→[Fe(SCN)n]3-n+4C1-
生成配合物后,其性质往往与原物质大不相同,如AgCl难溶于水,而[Ag(NH3)2]C1却易溶于水。
配离子在水溶液中存在着电离平衡,它和酸碱平衡、沉淀平衡、氧化还原平衡一样,只是一种相对的平衡状态。根据平衡移动的原理,如果改变溶液中某个离子的浓度,都会使原来的平衡发生移动。配位平衡与溶液的pH值、沉淀反应、氧化还原反应以及稀释作用等都有密切联系。
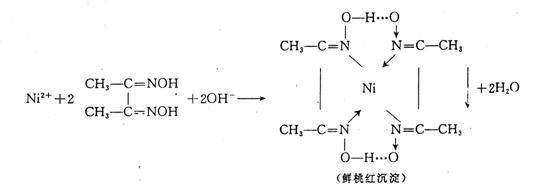
(2)环状结构的配合物叫螯合物,也称内配位化合物。许多金属的螯合物具有特征颜色,难溶于水而易溶于有机溶剂。分析化学中常以此类螯合物形成作为检验某金属离子的特征反应。例如:丁二酮肟与Ni2+离子在碱性环境里生成鲜桃红色难溶于水的螯合物——二丁二酮肟合镍。
反应式如下:
三、实验仪器和试剂
仪器:9孔穴板试管、滴管、洗瓶、玻璃棒、离心试管、电动离心机(公用)。
试剂:KSCN(0.1mol·dm-3)、CuSO4(0.1mol·dm-3)、NH3×H2O(2mol·dm-3,6mol·dm-3)、C2H5OH(95%)、K3[Fe(CN)6](0.1mol·dm-3)、FeCl3(0.1mol·dm-3)、NH4Fe(SO4)2(0.1mol·dm-3)、NH4SCN(0.1mol·dm-3)、NH4F(4mol·dm-3)、Na2CO3(0.5mol·dm-3)、HCl(6mol·dm-3)、NaCl(0.1mol·dm-3)、KBr(0.1mol·dm-3)、KI(0.1mol·dm-3)、Na2S(0.1mol·dm-3)
、AgNO3(0.1mol·dm-3)、NaOH(2mol·dm-3)、Na2SO3(0.5mol·dm-3)、饱和(NH4)2C2O4溶液、饱和Na2S2O3溶液、H2SO4(1:1)、CCl4、浓HCl、CoCl2(0.1mol·dm-3)、K4P2O7(0.1mol·dm-3)、NiSO4(0.1mol·dm-3)、磺基水杨酸(0.03mol·dm-3)、丁二酮肟(1%)、EDTA(0.1mol·dm-3)。
四、实验步骤
1.配合物的生成
(1)[Cu(NH3)4]2+正配离子的生成。
在9孔井穴板中,加入2~3滴0.1mol·dm-3
CuSO4溶液,然后加入1滴6mol·dm-3 NH3·H2O生成浅蓝色沉淀,继续加入6mol·dm-3
NH3·H2O直至生成的沉淀消失;观察溶液呈现的颜色,写出反应式。最后加入2cm3 95%酒精溶液,静置,观察深蓝色晶体析出。
(2)[Fe(SCN)6]3-负配离子的生成。
在井穴板中,加入2滴0.1mol·dm-3
FeCl3溶液;然后逐滴加人0.1mol·dm-3 KSCN溶液,注意观察沉淀的颜色并与溶液比较。
2.配合物与复盐、简单盐的区别
在9孔井穴板中,分别加入10滴0.1mol·dm-3的K3[Fe(NO3)3]、FeCl3、(NH4)2Fe(SO4)2,然后各加入1滴0.1mol·dm-3,NH4SCN,观察并解释现象。
3.含Fe(Ш)溶液体系中配位平衡的移动
(1)配离子之间的转化①。
往一支试管加入5滴0.5mol·dm-3
Fe(NO3)3溶液,然后加入3滴6mol×dm-3 HCl,振荡,观察溶液颜色变化,写出反应式。用同样的方法,依次加入0.1mol·dm-3
NH4SCN,加入4mol·dm-3 NH4F溶液,加入饱和(NH4)2C2O4溶液至溶液颜色发生明显变化。说明配离子之间转化的条件,写出各反应式。
(2)配位平衡与氧化还原反应。
取两支试管,分别加入5滴0.1mol·dm-3的FeCl3、K3[Fe(CN)6],再往试管中各自加入5滴0.1mol·dm-3 KI和0.5cm3 CCl4,振荡后观察CCl4层的颜色;比较两试管,解释现象,写出有关反应式。
(3)配位平衡与氧化还原反应。
取一支试管,加入2cm3 0.1mol·dm-3
FeCl3,然后滴加4mol·dm-3 NH4F至刚呈无色,将此溶液分成两份,在一份中滴加2mol·dm-3 NaOH,在另一份中滴加H2SO4(1:1),观察现象,写出反应式并加以解释。
4.含Ag+溶液体系的配位平衡与沉淀平衡
在1支试管中,加入5滴0.1mol·dm-3
AgNO3,然后依次进行下列实验,写出每一步骤的反应式。
(1)滴加0.1mol·dm-3
Na2CO3至刚生成沉淀。
(2)滴加2 mol·dm-3氨水至沉淀刚溶解。
(3)加入1滴0.1 mol·dm-3 NaCl生成沉淀。
(4)滴加6 mol·dm-3氨水至沉淀刚溶解。
(5)加入1滴0.1 mol·dm-3 KBr生成沉淀。
(6)滴加0.5 mol·dm-3
Na2S2O3,边滴边摇荡至沉淀刚溶解①。
(7)加入1滴0.1 mol·dm-3 KI生成沉淀。
(8)滴加饱和Na2S2O3,边滴边摇荡至沉淀刚溶解。
(9)滴加0.1 mol·dm-3
Na2S至生成沉淀。
注意每步只需加入量到刚生成沉淀或刚溶解即可。若溶液量太大,可弃去部分继续试验。
综上实验,说明配合平衡与沉淀平衡相互关系,比较Ksp(AgCl)、Ksp
(AgBr)、Ksp (AgI)、Ksp(Ag2S)的大小和K稳(Ag(NH3)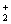 )、K稳(Ag(S2O3))的大小。
)、K稳(Ag(S2O3))的大小。
5.配位平衡与稀释作用
在一试管中加入5滴0.1 mol·dm-3
CoCl2,振荡下滴加浓盐酸至变蓝。振荡下加水稀释至变红。再滴加浓盐酸,溶液变蓝,再用水稀释,溶液变红。
反应式:
[Co(H2O)6]2++4Cl--=[ Co(H2O)2Cl4]2-+ 4H2O
6.螯合物的生成
(1)焦磷酸铜(Ⅱ)螯合离子的生成。
往一试管中加入5滴0.1 mol·dm-3
CuSO4,再加入0.1 mol·dm-3 K4P2O7至浅蓝色沉淀生成,继续滴加至沉淀溶解为深蓝色溶液。反应式为:
2Cu2++P2O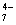 →Cu2P2O7↓
→Cu2P2O7↓
Cu2P2O7+3P2O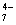 →2[Cu(P2O7)4]6-
→2[Cu(P2O7)4]6-
(2)丁二酮肟镍的生成
往一试管中加入1滴0.1 mol·dm-3
NiSO4和2滴mol·dm-3 NH3·H2O,再加入1滴0.03 mol·dm-3磺基水杨酸,振荡,最后加入0.1 mol·dm-3 EDTA至溶液变色,观察并解释现象。反应式:
Fe3++H2Sal(磺基水杨酸)→FeSal+(红褐色)+2H+
Fe3++H2Y2-(EDTA) →FeY-(黄色)+2H+
五、思考题
1.配离子是如何形成的?它与简单离子有何区别?如何证明?
2.配合物与复盐有何区别?如何证明?
3.什么叫螯合物?有些什么特性?配合剂和螯合剂有何区别和联系?
4.为什么FeCl3能与KI反应生成I2,而K3[Fe(CN)6]则不能?
六、参考文献
[1]陆根土编,《无机化学教程》(三、实验),南海出版公司,1995年。
[2]北京大学化学系普化教研室编,《普通化学实验》,北京大学出版社,1991年。
[3]邹振荡、郭良琮主编,《普通化学实验教程》,重庆大学出版社;1993年。
[4]高剑南主编,《现代化学基础》,华中师大出版,1998年。