|
一、实验目的
测定纯水在不同温度下的饱和蒸气压,求出在此温度范围内水的平均摩尔汽化焓。熟悉单组分系统的气—液平衡。
二、实验原理
一定温度下单组分液体与其蒸气达到平衡时液面上该组分气相的压力,称为此温度下纯液体的饱和蒸气压,简称蒸气压。两相平衡时蒸气压与温度的关系可用Calculus—Clapeymn方程表示
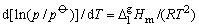
这里,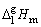 是相变时的摩尔汽化焓,它是温度的函数。温度变化不大时,可视为此温度范围内的平均摩尔汽化焓。单位为J×mol-1。R是摩尔气体常数,T是热力学温度, 是相变时的摩尔汽化焓,它是温度的函数。温度变化不大时,可视为此温度范围内的平均摩尔汽化焓。单位为J×mol-1。R是摩尔气体常数,T是热力学温度,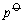 是标准态压力。将上式作不定积分可得到 是标准态压力。将上式作不定积分可得到
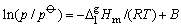
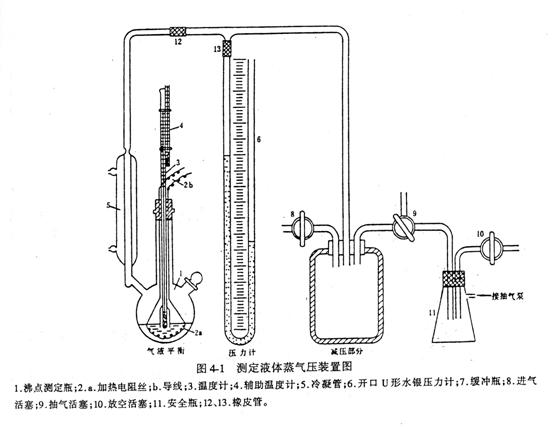
这里,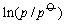 与1/T成直线关系。若以 与1/T成直线关系。若以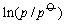 对1/T作图,由斜率可求出 对1/T作图,由斜率可求出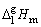 。因此可以通过测定纯物质在不同温度下的蒸气压来确定其摩尔相变焓。测定饱和蒸气压的方法有饱和气流法,静态法和动态法。本实验采用动态法。动态法是通过改变系统的压力来确定相应的温度。单组分气—液两相达到平衡时,若改变系统的压力,温度也随之改变。直至到达新的平衡点。每一个平衡点所对应的温度和压力,就是纯液体在此平衡点的沸点和蒸气压。实验装置见图4—1。图中,待测样品置于加热瓶中,整个系统经真空泵抽空形成负压后,加热瓶中的水。当瓶中有大量气泡逸出时,表示水在该压力下已达沸点,气—液两相达到平衡。因为双管汞压力计有一端与大气相通,所以大气压等于蒸气压加压力计的汞压差,从而可算出该温度下水的蒸气压。改变双管汞压力的压差时,沸点又相应改变,直至到达新的于衡。因此可测出各温度下水的蒸气压。 。因此可以通过测定纯物质在不同温度下的蒸气压来确定其摩尔相变焓。测定饱和蒸气压的方法有饱和气流法,静态法和动态法。本实验采用动态法。动态法是通过改变系统的压力来确定相应的温度。单组分气—液两相达到平衡时,若改变系统的压力,温度也随之改变。直至到达新的平衡点。每一个平衡点所对应的温度和压力,就是纯液体在此平衡点的沸点和蒸气压。实验装置见图4—1。图中,待测样品置于加热瓶中,整个系统经真空泵抽空形成负压后,加热瓶中的水。当瓶中有大量气泡逸出时,表示水在该压力下已达沸点,气—液两相达到平衡。因为双管汞压力计有一端与大气相通,所以大气压等于蒸气压加压力计的汞压差,从而可算出该温度下水的蒸气压。改变双管汞压力的压差时,沸点又相应改变,直至到达新的于衡。因此可测出各温度下水的蒸气压。
三、仪器与试剂
蒸气压测定装置一套;真空泵一台;重蒸馏水若干。
四、实验步骤
关闭活塞8、活塞10,接通三通活塞9于缓冲瓶7与安全瓶11;开动真空泵抽气,直至双管压力计6两侧汞柱高差约50cm后关闭活塞9。若压力计汞柱高差有变动,表示系统漏气,则应检查处理。若5min内汞柱高差基本不变,则可进行实验。打开回流冷凝管5(回流冷凝是防止蒸汽蒸发过快)的冷却水。然后接通电源,加热瓶1中的水。当瓶中有大量气泡逸出时,观察温度计,若温度停止上升并保持不变,记录温度与汞压力计两侧的汞柱高度。此为首次测定。然后小心地打开活塞8,放入一点空气,使压力计高端降低约2~3cm后关闭活塞8。继续如前次那样读数。按同法依次进行5次读数(每次压力降低应较前次稍大一点)。最后一次不再关闭活塞8,所测温度即为水的正常沸点。
五、数据处理
将每次测得的温度及相应的汞柱差列成表格。算出每个温度下水的蒸汽压及相应的对数值。以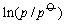 对1/T作图。由直线的斜率算出 对1/T作图。由直线的斜率算出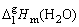 。 。
六、思考题
正常沸点与沸腾温度有何区别?
|