一、实验目的
测定萘的燃烧焓,了解热化学实验的有关知识。
二、实验原理
lmol物质在一定温度和压力下完全燃烧时的反应焓[变]称为摩尔燃烧焓[变]“完全燃烧”现规定为分子中的碳、氢、硫、氮诸元素燃烧后完全转变成CO2(g)、H2O(1)、SO2(g)和N2(g)。(有些数据表规定与此略有不同)
本实验用氧弹式量热计先测定萘的恒容热效应(即 ),然后按下式换算成摩尔燃烧焓[变](
),然后按下式换算成摩尔燃烧焓[变]( ):
):
 (1)
(1)
式中 是燃烧反应方程式中气体反应物和气体产物的计量系数。
是燃烧反应方程式中气体反应物和气体产物的计量系数。
实验时被测样品置于氧弹(一种特制的钢瓶)内,氧弹被密封并充有高压氧气。弹内装有一根用来点燃样品的金属丝(常称为点火丝),点火丝与外电路相连通。氧弹放在盛有一定量的金属桶(简称水桶)内,桶内还装有一温度计,水桶周围是隔热层。测量时,接通电源,点火。被加热燃烧熔断,样品即被引燃,点火丝和样品燃烧放出的热量传给周围的吸热介质(水和其它物件),引起介质的温度上升。所装温度计便反映出介质的温度变化。若介质与外界完全没有热交换,燃烧前后介质的温度变化为ΔT,视介质的热容W为常数,则点火丝通电燃烧产生的热量 和样品燃烧放出的热量
和样品燃烧放出的热量 之和的绝对值应等于介质吸收的热量WΔT即
之和的绝对值应等于介质吸收的热量WΔT即
 +
+ =W
=W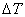
于是,若点火丝燃烧掉的长度为Δl厘米,单位长度点火丝的热效应为q,燃烧样品的质量为m,样品的摩尔质量为M,则样品的摩尔恒容热效应 应满足如下关系:
应满足如下关系:
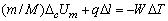 (2)
(2)
式中M、q为已知量(铁丝的q为-2.9J·cm-1),m由分析天平精确称量得到,Δl由尺子度量ΔT由温度计测出,若还知W,便可由该式求出样品的 。
。
确定(或称标定)量热计的吸热介质的热容W,是量热实验中必不可少的重要环节。最常用的标定方法是一定量已知热效应( )的标准物质,精确称量后,在所使用的量热计上进行实验,其操作步骤与测定未知热效应样品的完全相同,实验条件也尽可能相近。将所测得的数据代入式(2),便可求出W
)的标准物质,精确称量后,在所使用的量热计上进行实验,其操作步骤与测定未知热效应样品的完全相同,实验条件也尽可能相近。将所测得的数据代入式(2),便可求出W
 (3)
(3)
本实验是用苯甲酸作为标准物质,标定量热计的W的。
三、仪器试剂
氧弹式量热计一套;台称;分析天平;压片机;点火丝1000cm3容量瓶1个;氧气;苯甲酸(A.R.);萘(A.R.)。
四、实验步骤
首先,熟悉仪器装置。如图3-l(a)所示,水筒2内装有一定量的水,中间有氧弹(氧弹的结构如图3—1(b)所示)。这一部分(包括水桶在内)是吸热介质,是量热计的核心,是进行量热实验时所实际研究的系统。该系统与外界以空气层隔热。为减少空气对流、水蒸发、热辐射及环境温度变化的影响,系统被封闭起来,上方盖有带反光镜的热绝缘胶板盖,周围包有与系统温度相近的内壁抛光的恒温水套1。水桶下面垫有绝热塑料垫脚Uo桶内还装有搅拌器S1,以便使系统温度快速达到均匀。系统的温度变化由数显温度计T,测量,搅拌、点火计温等由附加的电器控制箱所控制。

用台称称取0.8g苯甲酸,在压片机上压片成型。用分析天平精确称量成型样品,得苯甲酸的质量m。准确量取长约15cm的点火丝。记录数据。
按照图3-2装样,把V形点火丝两端紧缠在两电极上,中间部位紧触样品。装毕后用万用电表检查两电极是否导通。若已导通,则放人氧弹筒内,拧紧弹盖。
将氧弹的的底座暂时取下,将进气孔与充氧器< 与氧气钢瓶、减压阀已连接)的亢气口连通,打开氧气钢瓶的出口阀,下压充氧器的手柄,使充人氧气的压力为15~20×105Pa(充气前已调节减压阀至该压力),充气约15秒,松开充氧器的手柄,取出氧弹,安装好氧弹底座,关闭氧气出口阀。充氧前后各用万用表检查氧弹电极的通路情况
。

将已充气的氧弹置于量热计的水桶内,用容量瓶取3000cm3水装人水桶中。将点火导线的插头插在氧弹的两电极上,盖上胶板盖,在盖中小孔处插人测温探头。然后,打开量热汁处理器的“电源”键,选择时间为半分钟,按“搅拌”锌,数分钟后再按“复位”键,示音即可读取温度数据。初期温度变化很小或几乎不变,读取5个温度数据后,按下“点火”键,继续计时读数,当温度变化很慢时、再读取5个数据即可停止实验。关闭搅拌开关和总电源开关。取出氧弹,卸下搅拌器;倒掉水桶里的水,将水桶、搅拌器重新装好以供下次实验使用。
打开氧弹排气孔,放掉废气,拧开氧弹盖,检查样品燃烧完全否(若坩埚内有许多黑色灰烬,则嬲烧不完全,实验失败)。然后仔细收集剩余的点火丝,点火丝燃烧前的长度减去剩余的长度即为点火燃烧掉的长度 。将氧掸、坩埚擦净,备下次实验使用。
。将氧掸、坩埚擦净,备下次实验使用。
以上为标定量热计的热容W的实验操作。接着测定萘的燃烧热,用台称称取0.6g的萘,按照上述步骤实验,记下各种数据。
五、数据处理
式(2)、(3)中的ΔT是系统(吸热介质)与外界完全无热交换下的温度变化,但实际上用的量热计在量热过程中系统与外界存在热交换,另外还有搅拌器不断工作,使得温度计的燃烧前后的温差并不和ΔT完全相等,而是有些偏差,因此在用式(2)、(3)进行计算时对所记录的温度变化加以校正。
校正温度通常采用雷诺图法,如图3—3、3—4所示。以时间为横坐标,温度为纵坐标图,得温度变化曲线abcd。b是开始燃烧时刻的温度,c是样品燃烧完毕时的温度。曲线ab常发生倾斜,这表明整个过程均存在热交换。其交换的热量可通过校正记录的温度来消除方法是在曲线bc上取点O,O点对应的温度为了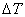 分别为点b、c对应的温度。过O点作纵坐标的平行线AB,作线db、cd的延长线分别与直线AB交于点E和F。E、F两点所对应的温度之差即为所求的校正的ΔT。
分别为点b、c对应的温度。过O点作纵坐标的平行线AB,作线db、cd的延长线分别与直线AB交于点E和F。E、F两点所对应的温度之差即为所求的校正的ΔT。
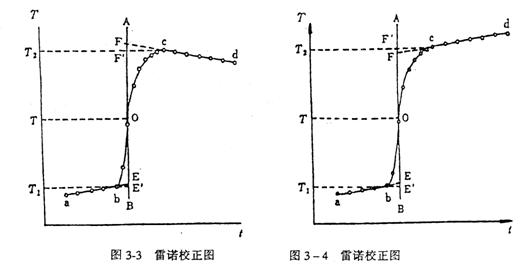
在图中, 和
和 对应的温差分别反映外界辐射热给系统和系统辐射热给外界引起的系统温度变化,前者是应扣除的,后者是应补偿的。经过这样校正的温差才接近完全没有热交换条件下的温差。更严格地处理可参阅有关量热学专著。
对应的温差分别反映外界辐射热给系统和系统辐射热给外界引起的系统温度变化,前者是应扣除的,后者是应补偿的。经过这样校正的温差才接近完全没有热交换条件下的温差。更严格地处理可参阅有关量热学专著。
校正燃烧苯甲酸所记录的温度变化,把得到的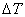 同其它数据一起代入式(3)确定出W(一般W应取多次测量的平均值,这里只作一次测量)。
同其它数据一起代入式(3)确定出W(一般W应取多次测量的平均值,这里只作一次测量)。
校正萘燃烧时所记录的温度变化,所得的ΔT同其它有关数据代人式(2)求出萘的 ,然后进一步通过式(1)求出萘的
,然后进一步通过式(1)求出萘的 。
。
苯甲酸和萘的燃烧反应式如下:
C7H6O2(s)+ O2(g)=7CO2(g)+3H2O(1)
O2(g)=7CO2(g)+3H2O(1)
C10H8(s)+12O2(g)=10CO2(g)+4H2O(1)
六、思考题
你所测定的燃烧焓[变]是否就是 ?
?