|
一、实验目的
1.了解天平的基本构造和性能。学会正确使用天平。
2.学习直接称量法和减量法称量操作。
3.学会容量瓶、移液管、滴定管的基本操作。了解一种标准溶液的配制方法。
4.学会酸碱滴定的基本操作。
5.培养准确、简明地记录实验原始数据的习惯,不得涂改数据,不得将测量数据记在实验记录本以外的任何地方。
二、实验原理
滴定分析是将一种已知准确浓度的标准溶液滴加到被测试样的液中,直到化学反应完全为止,然后根据标准溶液的浓度和体积,求得被测试样中组分含量的一种方法。酸碱滴定是一种常见的滴定分析法,它是利用酸碱中和反应的滴定分析法。将待测溶液由滴定管滴加到一定体积的酸或碱的标准溶液中去(也可以反过来加),使它们刚好完全反应。按照化学反应方程式的计算关系。可以从所用的酸溶液和碱溶液的体积(V酸和V碱)与酸溶液的浓度c酸(mol·dm-3)算出碱溶液的浓度c碱(mol·dm-3)。例如酸A和碱B发生以下中和反应:
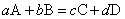
则发生反应的A和B的物质的量nA和nB之间有如下关系
 或 或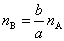
所以
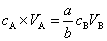
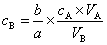
反之,也可以从c碱、V碱和V酸求出c酸。
酸碱中和反应的终点,常用指示剂的变色来确定,酸碱滴定法中常用的指示剂是甲基橙和酚酞。甲基橙的pH变色域是3.1(红)~4.4(黄),pH4.0附近为橙色;用NaOH滴定酸性溶液时,终点颜色变化是由橙变黄;用HCI溶液滴定碱性溶液时,终点颜色变化是由黄变橙。酚酞的pH变色域是8.0(无)~9.6(红)。用NaOH,HCl溶液不易直接配准,而是先配成近似浓度,然后用基准物质标定,常用的基准物质是无水碳酸钠和硼砂,因此本实验就是在较熟练使用分析天平的基础上,准确称取无水碳酸钠来标定HCI溶液。
三、仪器与药品
台称;电光分析天平;称量瓶;干燥器;50cm3酸式滴定管1支;锥形瓶250cm3,(2个);洗瓶;滴定管夹和铁架;10cm3小烧杯(两个);250cm3容量瓶;25cm3刻度吸液管1支;多用滴管1支;小玻璃棒1支。
无水Na2CO3(将无水Na2CO3置于烘箱内,在180℃下,干燥2~3h,然后放到干燥器内冷却备用)。
HCl(0.1mol·dm-3)
甲基橙(0.1%水溶液)
四、实验内容
1.称量练习
(1)取两个干燥的10cm3小烧杯,在分析天平上称准至0.1mg,记录为m0和m´0。(分析天平使用方法见P16)
(2)取一个盛有一定量CuSO4·5H2O的称量瓶,先在台称上粗标其大致质量;再在分析天平上精确称量,记录为m1,取出CuSO4·5H2O,0.4~0.5g于小烧杯1中,准确称量并记录称量瓶的剩余量m2,以同样方式转移试样0.4~0.5g于小烧杯2中,准确称量并记录称量瓶和剩余试样的质量m3。
(3)分别精确称量已经装有试样的两个小烧杯,记录其质量分别为m4和m5。
(4)参照下表记录实验数据并计算实验结果
|
项 目
|
第一份(I)
|
第二份(Ⅱ)
|
|
称量瓶+试样重(倾出样前)(g)
称量瓶+试样量(倾出样品后)(g)
倾出试样重(g)
|
m1
m2
m1-m2
|
m2
m3
m2 -m3
|
|
小烧杯+试样重(g)
空小烧杯重(g)
称取试样重(g)
|
m4
m0(器皿1)
m4-m0
|
m5
m´0(器皿2)
m5-m´0
|
|
偏 差
|
|
|
(5)数据处理与检验
倾出试样I的质量为(m1-m2)g,应等于称取试样1的质量(m4-m0)g,倾出试样Ⅱ的质量(m2-m3)g,应等于称取试样Ⅱ的质量(m5-m´0)g。如不等,则应计算其偏差,实验要求其偏差小于0.4mg,若满足实验要求可以进行下一步实验,若不能满足实验要求,则应继续反复练习,直到合乎实验要求。
2.配制Na2CO3的标准溶液
(1)在分析天平上,用减量法精确称取无水Na2CO3 0.5~0.7g,置于10ml小烧杯中。
(2)在装有无水碳酸钠的小烧杯中,加入约10cm3蒸馏水,使Na2CO3完全溶解,将此溶液定量转移到250cm3容量瓶中,用少量蒸馏水洗涤小烧杯三次,洗涤液一并加入到容量瓶中,加入蒸馏水至刻度,摇匀。计算Na2CO3标准溶液的浓度,保留四位有效数据。
3.标定HCl溶液:
将已经洗净的酸式滴定管,用少量待装溶液洗涤2~3次,然后加入HCl溶液至零刻度以上,排除滴定管下端的气泡,调节其液面为零刻度。
移取25.00cm3标准Na2CO3溶液置于锥形瓶中,加入2滴甲基橙指示剂,在不断摇动锥形瓶的情况下,中和溶液,刚开始滴定时,可以适当快一些,但必须成滴而不是一股水流,当溶液的局部出现橙红色,并在摇动锥形瓶时,其橙红色消失较慢时,表示已接近终点,这时应控制滴加速度。每加一滴HCl溶液,都应观察,在摇动锥形瓶时,颜色是否消褪,再决定是否加HCl溶液,直到溶液由黄色变为橙色,即到达了滴定终点,记下所消耗的HCl体积。
另取25.00cm3 Na2CO3,溶液,用HCl溶液滴定,要求两次滴定所耗HCl的体积之差小于0.08cm3,若超过0.08cm3,则要求滴定第三份。
滴定过程中应注意以下几点:
(1)滴定完毕后,滴定管下端尖嘴外不应挂有液滴,尖嘴内不应留有气泡。
(2)滴定过程中,可能有HCl溶液溅到锥形瓶内壁的上部;最后半滴酸液也是由锥形瓶内壁沾下来,因此,为了减少误差,快到终点时,应该用洗瓶吹取少量蒸馏水淋洗锥形瓶内壁。
4.按下表的格式记录及整理实验数据
|
项 目
|
第一次
|
第二次
|
第三次
|
|
Na2CO3/mol·dm-3
|
|
|
|
|
Na2CO3溶液的浓度(mol·dm-3)
|
|
|
|
|
Na2CO3溶液的用量(cm3)
|
|
|
|
|
HCl溶液的浓度(mol·dm-3)
|
|
|
|
|
HCl溶液的平均浓度(mol·dm-3)
|
|
|
|
五、预习要求
1计算配制250cm3 0.05mol·dm-3 Na2CO3溶液所需无水Na2CO3的质量。
2.预习误差及有效数据,分析天平的使用,滴定管的使用,移液管的使用,容量瓶的使用等有关内容。
六、思考题
1.为了保护天平的玛瑙刀口,操作时应注意什么?以下操作是否允许?
(1)急速地打开或关闭升降旋钮。
(2)未关升降旋钮就加减砝码或取放称量物。
2.下列情况对称量读数有无影响?
(1)用手直接拿取砝码或称量物品。
(2)未关天平门。
3.称量时,缩微标尺向称量物体方向移动,应该加砝码还是减砝码?反之,又如何?
4.使用称量瓶应注意什么?从称量瓶向外倒样品时应怎样操作?为什么?
5.为什么移液管和滴定管必须用欲装入的溶液洗涤?锥形瓶是否也要用待装溶液洗涤?
|