|
一、实验目的
1.了解Fe3+、Fe2+、Co2+、Co3+、Ni2+、Ni3+的氢氧化物及硫化物的生成与性质。
2.了解Fe2+、Co2+、Ni2+化合物的还原性和Fe3+、Co3+、Ni3+化合物的氧化性及变化规律。
3.了解Fe3+、Fe2+、Co2+、Co3+、Ni2+、Ni3+配合物的生成与性质。
4.学习铁、钴、镍的离子的鉴定方法及其在定性分析上的应用。
二、实验原理
铁、钴、镍为第四周期,第Ⅷ族元素,属于第一过渡系,也称铁系元素。由于它们是同一周期的相邻元素,其原子结构相似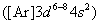 原子半径相近(117-115pm),故它们的性质相似,常共生于自然界,铁、钴、镍氧化数为+2和+3的化合物氧化还原性大小可由下列标准电极电势看出。在酸性介质中: 原子半径相近(117-115pm),故它们的性质相似,常共生于自然界,铁、钴、镍氧化数为+2和+3的化合物氧化还原性大小可由下列标准电极电势看出。在酸性介质中:

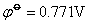

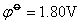
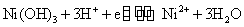
由此可见, 值最小,因此Fe2+具有还原性,Co3+、Ni3+是强的氧化剂。 值最小,因此Fe2+具有还原性,Co3+、Ni3+是强的氧化剂。
在碱性介质中,铁系元素有关反应的电极电势如下:
 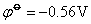

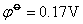

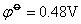
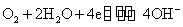 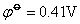
由上可知高氧化数氢氧化物的氧化性按Fe-Co-Ni顺序依次增加,而低氧化数氢氧化物的还原性Fe-Co-Ni顺序减弱。Ni(OH)3是其中最强的氧化剂,而Fe(OH)2是其中最强的还原剂。
还原性增强

Fe(OH)2
Co(OH)2
Ni(OH)2 白色 粉红色 浅绿色
Fe(OH)3 Co(OH)3
Ni(OH)3
红棕色
棕色
黑色

氧化性增强
向Fe2+、Fe3+、Co2+、Ni2+盐溶液中加入碱液,则析出相应的氢氧化物沉淀。析出的白色Fe(OH)2沉淀很快就被空气中氧氧化为红棕色的Fe(OH)3(氧化过程中可观察到各种中间颜色的中间产物的生成),Co(OH)2则缓慢被氧化成棕色的Co(OH)3;而Ni(OH)2不与氧作用,在空气中稳定存在,要用较强的氧化剂例如溴才能使之氧化。
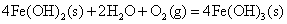
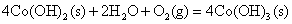
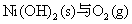 不反应。 不反应。
在酸性介质中,Fe2+能使Br2水褪色,而Co2+、Ni2+都不能,显示出Fe2+的还原性。
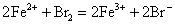
碱性介质中Fe2+、Co2+、Ni2+均能被Br2水氧化,相应生成Fe(OH)3、Co(OH)3、Ni(OH)3沉淀。
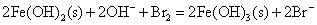
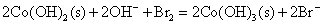
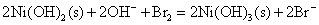
Co(OH)3、Ni(OH)3的氧化以及在酸性介质中Co3+、Ni3+的氧化性比Fe(OH)3或Fe3+更强,它们能将浓HCl中Cl-离子氧化放出氯气,可用KI淀粉试纸检验,而它们自身变成+2价的盐。
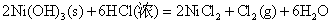
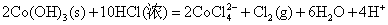
Fe(OH)3只能与浓盐酸起酸碱反应而生成+3的铁盐。
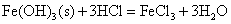
Fe3+离子能与较强还原剂KI作用,将I-氧化为I2。
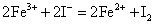
试验过程中生成的I2可用CCl4萃取,观察CCl4层颜色。
Fe2+、Co2+、Ni2+都能生成不溶于水而溶于稀酸的硫化物,但NiS、CoS一旦自溶液中析出放置后,结构会迅速发生变化。如NiS可由初生成a-NiS,溶度积由3.2×10-19降为2.0×10-26,这样使NiS、CoS成为更难溶硫化物,不再溶于稀酸。
铁、钴、镍的离子易形成配离子,分析上常利用铁、钴、镍的离子生成特殊颜色的配合物的反应作为这些离子的鉴定反应。它们重要配位化合物有氰合物、氨合物、硫氰合物等。
在Fe3+溶液中加入亚铁氰化钾K4[Fe(CN)6]溶液(俗称黄血盐),则生成蓝色沉淀(常称普鲁土蓝);在Fe2+溶液中加入铁氰化钾也生成蓝色沉淀(常称腾氏蓝)。普鲁土蓝和腾氏蓝实际上是同一物质,因此它们的反应可表示为:
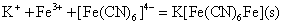
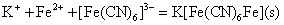
Co2+离子与KSCN固体生成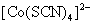 配离子,但离解度较大,加入丙酮,可形成较稳定的特征颜色的 配离子,但离解度较大,加入丙酮,可形成较稳定的特征颜色的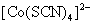 配离子。 配离子。
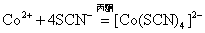 蓝色 蓝色
Ni2+与丁二酮肟(又叫二乙酰二肟,或简称丁二肟)反应得到玫瑰红色的螯合物。此反应在弱碱条件下进行,酸度过大不利于内配盐的生成;碱度过大则生成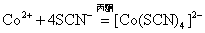 适宜条件是pH=5~10。 适宜条件是pH=5~10。
也可简写成:


三、仪器和药品
1.仪器
点滴板以及其他普化实验仪器。
2.药品:
H2SO4(1mol·dm-3) HCl(2mol·dm-3、12mol·dm-3)
氨水(2mol·dm-3)
NaOH(2mol·dm-3、6mol·dm-3)
CoCl2(0.1mol·dm-3)
KI(0.1mol·dm-3)
NiSO4(0.1mol·dm-3)
K4[Fe(CN)6](0.1mol·dm-3)
FeCl3(0.1 mol·dm-3)
K4[Fe(CN)6](0.1mol·dm-3)
KSCN(mol·dm-3)
丙酮
溴水
H2S(饱和溶液)
CCl4
丁二肟(1%)
KI-淀粉试纸
FeSO4·7H2O(s)
KSCN(s)
四、实验内容
1. Fe2+、Co2+、Ni2+氢氧化物的制备与性质
(1)Fe(OH)2的制备与还原性:取A、B两支试管,A管中加入2ml去离子水和2~3滴1mol·dm-3
H2SO4酸化,煮沸,以驱除溶解的氧,然后加入几粒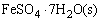 使之溶解;在B管中加入1ml mol·dm-3
NaOH溶液,煮沸驱氧,冷却后用一长滴管吸取该溶液,迅速将滴管插入A管溶液底部,挤出NaOH溶液,观察产物的颜色和状态。摇荡后分装于3支试管中,其一放在空气中静置,另两支试管分别加HCl溶液(2mol·dm-3)和NaOH溶液(2 mol·dm-3),观察现象,写出有关反应式。 使之溶解;在B管中加入1ml mol·dm-3
NaOH溶液,煮沸驱氧,冷却后用一长滴管吸取该溶液,迅速将滴管插入A管溶液底部,挤出NaOH溶液,观察产物的颜色和状态。摇荡后分装于3支试管中,其一放在空气中静置,另两支试管分别加HCl溶液(2mol·dm-3)和NaOH溶液(2 mol·dm-3),观察现象,写出有关反应式。
(2)Co(OH)2的制备与还原性:在1支试管中加入10滴0.1mol·dm-3 CoCl2溶液,先将溶液加热,再滴加6 mol·dm-3 NaOH,观察最初生成蓝色的碱式氯化钴沉淀Co(OH)Cl,接着转变为粉红色Co(OH)2沉淀。将Co(OH)2沉淀分成3份,两份里分别加2mol·dm-3的HCl和NaOH,试验它的酸碱性,一份静置片刻,观察现象,写出反应式。
(3)Ni(OH)2的制备与还原性:用NiSO4溶液(0.1mol·dm-3)代替CoCl2溶液重复实验1.(2)。
通过以上三个实验归纳出Fe2+、Co2+、Ni2+产氢氧化物的酸碱性和它们的还原性强溺顺序
2.Fe3+、Co3+、Ni3+氢氧化物的制备与氧化性
(1)Fe(OH)3的制备与氧化性:取:0.1mol·dm-3 FeCl3溶液0.5ml,滴加2 mol·dm-3 NaOH,观察沉淀的颜色和状态,然后加入几滴浓HCl微热,用润湿的淀粉—KI试纸检验是否有氯气逸出。写出反应方程式。
(2)Co(OH)3的制备与氧化性:取0.1mol·dm-3 CoCl2溶液0.5ml,加入几滴溴水,再滴加2mol·dm-3 NaOH溶液,观察沉淀的颜色和状态。然后加入浓HCl 0.5ml,加热并用润湿的淀粉-KI试纸检验逸出的气体,观察现象并写出反应方程式。
(3)Ni(OH)3的制备和氧化性:用NiSO4溶液代替上面的CoCl2溶液进行与2.(2)相同的实验并观察。
根据上述三个试验结果,比较Fe3+、Co3+、Ni3氢氧化物的制备和氧化性有何不同?
3.Fe、Co、Ni硫化物制备和性质
(1)在3支试管中,分别加入FeSO4(自己配制),0.1mol·dm-3 CoCl2和0.1mol·dm-3 NiSO4溶液数滴,并用稀HCl酸化,然后分别加入饱和H2S水溶液,观察有无沉淀产生?然后各加入2mol·dm-3氨水,使溶液呈碱性;观察有无沉淀产生?如产生沉淀,放置片刻,再加入稀HCl,沉淀是否溶解?CoS和NiS沉淀性质有何变化?解释实验现象。
(2)在一试管中,加入数滴0.1mol·dm-3 FeCl3溶液,用稀HCl酸化后,加人饱和H2S水溶液,观察并解释现象。然后再加入2mol·dm-3氨水,有无沉淀产生?
由上述实验,总结铁、钴、镍硫化物性质。
4.铁、钴、镍的配位化合物及其在定性分析上的应用
(1)Fe3+的鉴定:在点滴板一凹穴中,加入0.1mol·dm-3 FeCl3和KSCN溶液各一滴,观察现象,写出反应式。或在点滴板的一凹穴中,加人0.1mol·dm-3 FeCl3与K4[Fe(SCN)6]溶液各一滴,观察现象,写出反应式。
(2)Fe2+离子鉴定:在点滴板一凹穴中,加入一粒FeSO4·7H2O(s)和2滴2mol·dm-3 HCl,和一滴0.1mol·dm-3 K3[Fe(CN)6]溶液,观察现象,写出反应方程。
(3)Co2+离子鉴定:在点滴板一凹穴中,加入一滴0.1mol·dm-3 CoCl2溶液,再加入少量KSCN(s)及数滴丙酮,反应生成的蓝色[Co(SCN)4]2-配离子能在丙酮中稳定存在。
(4)Ni2+离子鉴定:在点滴板一凹穴中,加入0.1mol·dm-3 NiSO4和1%丁二肟试剂各一滴,由于Ni2+离子与丁二肟生成稳定配合物(螯合物)产生鲜红玫瑰色沉淀。
5.混合离子的分离与鉴定
(1)Fe3+和Co2+的混合溶液;
(2)Fe3+和Ni2+的混合溶液;
(3)Fe3+、Cr3+、Co2+的混合溶液;
五、预习要求
1.学习Fe、Co、Ni及主要化合物性质的有关内容。
2.拟定混合离子分离和鉴定的实验方案。
六、预习思考题
1.制取Fe(OH)2时为什么要先将有关溶液煮沸?
2.制取Co(OH)3、Ni(OH)3时为什么要以Co2+、Ni2+为原料在碱性溶液中进行氧化,而不用Co3+、Ni3+直接制取?
3.根据氧化还原反应,试判断某地区含有H2S的地下水中,是否可能有大量三价铁盐存在?
|