|
一、实验目的
(1)试验并了解铬和锰的主要价态化合物的生成和性质。
(2)了解铬和锰化合物的氧化还原性以及介质对氧化性质的影响。
二、实验原理
铬和锰分别为周期系ⅥB族、ⅦB族元素,它们都可变的氧化数。铬的价电子层结构为3d54s1,所以铬的氧化数有+2、+3、+6,但是铬的主要氧化数为+3、+6。锰的价电子层结构为3d54s1,所以锰的氧化数有+2、+3、+4、+5、+6、+7,其主要化合物为+2、+4、+7所形成的化合物。
(1)铬的主要价态化合物的生成和性质
铬的几种主要氧化数的化合物颜色见表21-1。
+3价铬的氢氧化物呈两性,它既能溶于酸又能溶于碱。
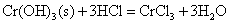
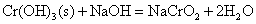
+3价铬盐容易水解,Cr2S3由于水解生成难溶的Cr(OH)3沉淀和H2S气体,使水解剧烈,以致Cr2S3不能在水溶液中存在。
表21-1
|
氧化数
|
+3
|
+6
|
|
水溶液中离子存在形式
|
[Cr(H2O)6]3+
|
[Cr(H2O)5Cl]2+-[CrCl6]3+
|
[Cr(OH)4](或 ) )
|

|
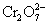
|
|
颜色
|
灰紫
|
浅绿-暗绿
|
亮绿
|
黄
|
橙
|
|
存在于溶液中条件
|
酸性
|
强碱性
|
pH>6
|
pH<2
|
注:Cr2+、Fe2+、Co2+、Ni2+、Cu2+等的水合离子呈显颜色都是由于发生d-d跃迁的结果。当水合离子中的水分子被其他配位所取代(如水分子被Cl-离子取代),由于配位场强发生变化,d轨道的分裂能会发生改变,从而引起吸收光波长的变化,导致离子颜色的改变。
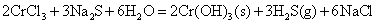
或
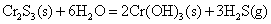
在碱性条件下, 离子可被 离子可被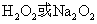 等氧化剂氧化为黄色的铬酸盐。 等氧化剂氧化为黄色的铬酸盐。
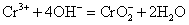
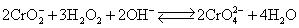
铬酸盐和重铬酸盐在水溶液中存在着下列平衡:
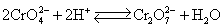
上述平衡在酸性介质中,向生成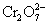 方向移动,在碱性介质中,向生成 方向移动,在碱性介质中,向生成 方向移动。 方向移动。
铬酸盐的溶解度通常远小于重铬酸盐的溶解度,因此在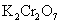 溶液中,由于存在 溶液中,由于存在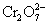 与 与 离子的平衡,当加入 离子的平衡,当加入 溶液,得到是 溶液,得到是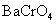 的浅黄色沉淀,而不是 的浅黄色沉淀,而不是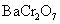 沉淀。 沉淀。
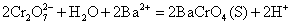
常见的难溶性铬酸盐有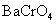 (黄)、 (黄)、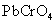 (黄)和 (黄)和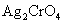 (砖红色)。 (砖红色)。
铬酸盐和重铬酸盐在酸性条件下,都是强氧化剂,易被还原为+3价铬离子。在酸性溶液中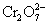 可与H2S、I-、 可与H2S、I-、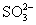 等还原剂发生反应。 等还原剂发生反应。
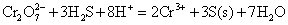
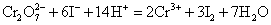
由于在酸性溶液中,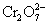 成为很强氧化剂,它甚至可氧化浓HCl中的Cl-离子。 成为很强氧化剂,它甚至可氧化浓HCl中的Cl-离子。
根据标准电极电势表
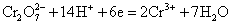
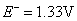
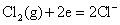
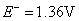
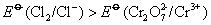 ,所以在标准状态下,下列反应是不能正向进行的。 ,所以在标准状态下,下列反应是不能正向进行的。
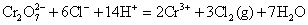
但由于加入浓HCl(12mol·L-1),使c(H+)= c(Cl-)≈12mol·L-1,将c(H+)、c(Cl-)分别代入能斯特公式,可估算出上述两电对的电极电势E(假设c(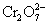 ) ) , , ,则 ,则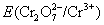 大为增加,而 大为增加,而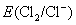 大为降低,使 大为降低,使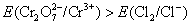 ,这样 ,这样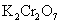 可作为氧化剂将浓HCl氧化放出 可作为氧化剂将浓HCl氧化放出 ,而自身被还原为绿色的 ,而自身被还原为绿色的 离子。 离子。
在重铬酸盐的酸性溶液中,加入少量乙醚和过氧化氢溶液,并摇荡,乙醚层呈蓝色:
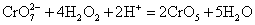
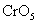 称为过氧化铬,这个反应常用来检验铬。 称为过氧化铬,这个反应常用来检验铬。
(2)锰的主要氧化态的化合物的生成和性质
锰的几种主要氧化数化合物的颜色见表21-2
表21-2
|
氧化数
|
+2
|
+4
|
+6
|
+7
|
|
水溶液中离子存在形式
|
[Mn(H2O)6]2+
|
无
|
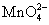
|
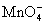
|
|
颜色
|
浅桃红(稀释时无色)
|
/
|
绿
|
紫红
|
|
存在于溶液中的条件
|
酸性稳定
|
|
pH>11.5时稳定
|
中性稳定
|
+2价锰的氢氧化物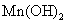 为白色,易溶于稀酸而不溶于碱。在空气中易被氧化,逐渐变为 为白色,易溶于稀酸而不溶于碱。在空气中易被氧化,逐渐变为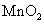 的水合物 的水合物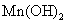 (即亚锰酸 (即亚锰酸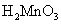 )。亚锰酸不溶于稀酸。 )。亚锰酸不溶于稀酸。
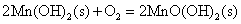
(棕色)
+2价锰离子只能在碱性条件下与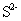 离子结合,生成肉色MnS溶解度较其他难溶性金属硫化物溶解度大,因此能溶于稀HCl,甚至溶于醋酸。MnS沉淀易被空气中的氧所氧化,并有S生成,所以不宜放置。 离子结合,生成肉色MnS溶解度较其他难溶性金属硫化物溶解度大,因此能溶于稀HCl,甚至溶于醋酸。MnS沉淀易被空气中的氧所氧化,并有S生成,所以不宜放置。
+2价锰离子是很弱的还原剂,在稀HNO3或稀H2SO4存在下(不能用稀HCl作介质,为什么?)与强氧化剂NaBiO3(土黄色固体)反应,生成紫色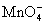 离子。 离子。
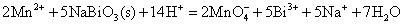
这个反应可常用来鉴定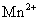 离子。 离子。
+6价锰酸盐仅在强碱性介质中稳定。从下列电势图
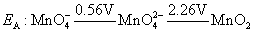
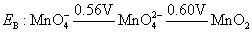
由EB可以看出, 在1mol·L-1的OH-溶液中,就可以自发地发生歧化反应。随溶液的酸度增加,由EA可以看出,歧化反应进行得越彻底,生成紫色的 在1mol·L-1的OH-溶液中,就可以自发地发生歧化反应。随溶液的酸度增加,由EA可以看出,歧化反应进行得越彻底,生成紫色的 离子和棕色 离子和棕色 沉淀的趋势越大,反应方程式如下: 沉淀的趋势越大,反应方程式如下:
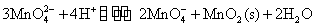
或
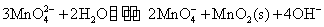
上述反应是可逆反应,但逆向反应较困难,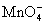 和 和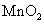 只有强碱性(pH>11.5)和加热的条件下,才能生成稳定的绿色 只有强碱性(pH>11.5)和加热的条件下,才能生成稳定的绿色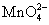 离子。 离子。
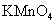 是强氧化剂,它的还原产物随介质的酸碱性不同而不同。 是强氧化剂,它的还原产物随介质的酸碱性不同而不同。
在酸性介质中:
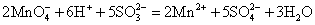
在中性或弱碱性介质中:
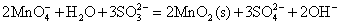
在强碱性介质中(pH>11.5):
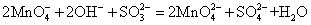
三、仪器和药品
1.仪器
常用普化实验仪器。
2.药品
HNO3(2mol·dm-3)
HCl(2 mol·dm-3、12 mol·dm-3)
HAc(6
mol·dm-3)
H2SO4(1 mol·dm-3、3 mol·dm-3)
氨水(2 mol·dm-3)
NaOH(2 mol·dm-3、6 mol·dm-3)
Cr(NO3)3(0.1 mol·dm-3) Pb(NO3)2(0.1 mol·dm-3)
Na2S(0.1 mol·dm-3)
AgNO3(0.1 mol·dm-3)
K2CrO4(0.1
mol·dm-3) MnSO4(0.1 mol·dm-3)
K2Cr2O7(0.1
mol·dm-3)
KMnO4(0.01
mol·dm-3)
BaCl2(0.1 mol·dm-3)
Na2SO3(1 mol·dm-3)
H2O2(3%)
NaBiO3(s)
MnO2(s)
H2S(饱和溶液)
淀粉KI试纸
乙醚
四、实验内容
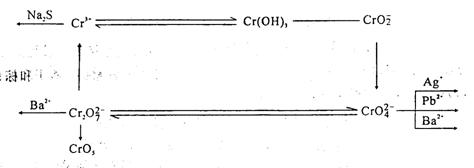
1.铬的化合物
用实验室已有的试剂,试设计完成下列反应,并说明各步反应的实验现象。小结所涉及铬的主要氧化态的化合物的性质及铬(III)、铬(VI)相互转化规律,写出有关反应方程式。
2.锰的化合物
(1)的氢氧化物的制备和性质:用0.1 mol·dm-3
MnSO4溶液制备Mn(OH)2,迅速观察沉淀的颜色。试验Mn(OH)2的酸碱性。
取少量Mn(OH)2置于另一试管中,在空气中摇荡,注意沉淀颜色的变化。解释现象并写出有关反应式。
(2) 的硫化物的生成和性质:取5滴0.1mol·dm-3 MnSO4溶液,加入数滴0.1mol·dm-3 Na2S,观察生成沉淀的颜色。再于沉淀上加数滴6mol·dm-3
HAc,观察沉淀是否溶解并写出反应式。 的硫化物的生成和性质:取5滴0.1mol·dm-3 MnSO4溶液,加入数滴0.1mol·dm-3 Na2S,观察生成沉淀的颜色。再于沉淀上加数滴6mol·dm-3
HAc,观察沉淀是否溶解并写出反应式。
(3) 离子的还原性( 离子的还原性(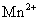 离子的鉴定反应):取1~2滴0.1mol·dm-3 MnSO4溶液,然后加10滴2mol·dm-3 HNO3及1ml去离子水,最后再加入少量NaBiO3固体,充分摇荡后静置数分钟,待剩下未起反应NaBiO3土黄色固体沉降后,观察上层清液的颜色有何变化?写出反应式。 离子的鉴定反应):取1~2滴0.1mol·dm-3 MnSO4溶液,然后加10滴2mol·dm-3 HNO3及1ml去离子水,最后再加入少量NaBiO3固体,充分摇荡后静置数分钟,待剩下未起反应NaBiO3土黄色固体沉降后,观察上层清液的颜色有何变化?写出反应式。
(4)Mn(VI)的化合物的生成和性质:
A.在5滴0.01mol·dm-3 KMnO4溶液中加入2~3ml 6mol·dm-3 NaOH,在此强碱性介质下,加入少量MnO2固体,加热沸腾1min后,静置片刻,观察上层清液呈现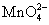 离子的特征绿色,写出反应式。制得的 离子的特征绿色,写出反应式。制得的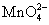 溶液供下面实验用。 溶液供下面实验用。
B.吸取已制得的1ml
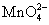 溶液,加入3 mol·dm-3 H2SO4酸化,观察溶液颜色的变化以及是否有沉淀析出?并写出反应式。 溶液,加入3 mol·dm-3 H2SO4酸化,观察溶液颜色的变化以及是否有沉淀析出?并写出反应式。
(5)Mn(Ⅶ)化合物的氧化性(KMnO4在不同介质中还原产物不同):在3支试管中分别加入0.5ml 1mol·dm-3 H2SO4、去离子水和6 mol·dm-3 NaOH,然后在各试管中加入0.5ml 1 mol·dm-3 Na2SO3摇匀后,各加入0.01 mol·dm-3 KMnO4溶液数滴,观察KMnO4在酸性、中性和强碱性介质中与Na2SO3溶液反应的现象,产物各是什么?写出反应式。
五、预习要求
1.学习Cr、Mn及其主要化合物性质的有关内容。
2.拟定好设计试验的实验方案。
六、预习思考题
1.怎样从实验确定Cr(OH)3是两性氢氧化物?
2.在本实验中如何实现从 的转变? 的转变?
3. 与 与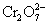 离子在水溶液中颜色有何不同?介质的酸碱性对 离子在水溶液中颜色有何不同?介质的酸碱性对 和 和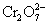 在溶液中存在形式有何影响? 在溶液中存在形式有何影响?
4 Mn(OH)2.是否两性?将Mn(OH)2放在空气中,将产生什么变化?为什么Mn2+在空气中比Mn(OH)2稳定?
5. KMnO4还原产物和介质有何关系?
6.如何分离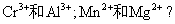
|