|
用不同方法使难溶无机化合物进入水溶液是无机化学实验中的一项重要操作。根据溶度积规则,如果采用不同措施,利用离子反应降低溶液中组成离子的浓度可使这些化合物溶解于水。某些物质必须采用熔融转化的方法使之成为可溶性物质。例如,α-Al2O3、灼烧后的Cr2O3、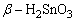 、 、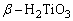 等,用酸碱试剂都不能使之溶解。通常采用碱熔或盐溶法使它们转变成可溶性的盐: 等,用酸碱试剂都不能使之溶解。通常采用碱熔或盐溶法使它们转变成可溶性的盐:
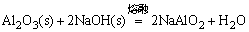
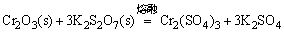
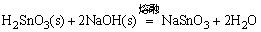
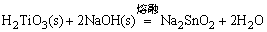
生成的NaAlO2,Cr2(SO4)3,Na2SnO3,Na2TiO3均可溶于水。
仪器、药品及材料
1.仪器:离心机 铁坩锅 泥三角 煤气灯(或酒精灯) 铁三脚架 坩埚钳
2.药品
酸:HNO3(2.0mol·dm-3, 6.0 mol·dm-3,浓) HCl(2.0 mol·dm-3, 6.0 mol·dm-3,浓) H2SO4(2.0 mol·dm-3)
碱:NaOH(2.0 mol·dm-3)NH3·H2O(2.0 mol·dm-3,6.0 mol·dm-3,)
盐:Pb(NO3)2(0.1 mol·dm-3)
Bi(NO3)3(0.1mol·dm-3)
Cd(NO3)2(0.1mol·dm-3,)
CuSO4(0.1mol·dm-3) NaCl(0.1 mol·dm-3)
BaCl2(0.1mol·dm-3) AlCl3(0.1mol·dm-3) FeCl3(0.1mol·dm-3) ZnCl2(0.1mol·dm-3) HgCl2(0.1 mol·dm-3)
SnCl4(0.1 mol·dm-3) KBr(0.1 mol·dm-3) KI(0.1
mol·dm-3,2.0 mol·dm-3) Na2S(0.1
mol·dm-3) NaSiO3(0.5
mol·dm-3)
Na2CO3(饱和) (NH4)2C2O4(0.1 mol·dm-3) Na2S2O3(0.1
mol·dm-3)
固体:CaCO3 ZnO α-Al2O3 Cr2O3(灼烧过的) K2S2O7 NaOH
3.材料:Pb(Ac)
2试纸
实验内容
1.酸碱溶解法
(1)酸溶解
①取1mL FeCl3溶液(0.1 mol·dm-3)于试管中,加NaOH溶液(2.0
mol·dm-3)至有大量红棕色沉淀生成。离心分离,弃去清液,向沉淀中滴加HCl溶液(2.0
mol·dm-3),观察沉淀的溶解。
②在0.5ml ZnCl2溶解(0.1 mol·dm-3)中滴加Na2S溶液(0.1
mol·dm-3)有白色沉淀生成,离心分离,弃去清液,在沉淀中滴加HCl溶液(2.0mol·dm-3),观察沉淀的溶解。
③用HNO3溶液(2.0 mol·dm-3)溶解Bi(NO3)3的水解产物。
④用1mL CuSO4(0.1 mol·dm-3)中滴加NaOH溶液(2.0 mol·dm-3)至有浅蓝色沉淀生成,加热至沉淀变成黑色,离心分离,弃去清液,在沉淀中滴加H2SO4(2.0 mol·dm-3),沉淀是否溶解?
⑤取少量CaCO3(S)于试管中,滴加HCl溶液(2.0 mol·dm-3),有何现象?
⑥取几滴BaCl2(s)溶液(0.1 mol·dm-3)于试管中,加几滴(NH4)2C2O4溶液(0.1 mol·dm-3),有何现象?离心分离,弃去清液,在沉淀中滴加HCl(6.0 mol·dm-3),沉淀是否溶解?
(2)碱溶解
①在2mL Na2SiO3溶液(0.5 mol·dm-3)中,滴加HCl溶液(6.0
mol·dm-3)至pH值为5~10,微热至出现胶冻状物,然后滴加NaOH溶液(2.0 mol·dm-3),观察现象。
②取少量ZnO(S)于试管中,滴加NaOH溶液(2.0
mol·dm-3),有何现象?
③在1mL
AlCl3溶液(0.1 mol·dm-3)中,滴加NH3·H2O溶液(6.0 mol·dm-3)至有大量白色沉淀生成,离心分离,在沉淀中滴加NaOH溶液(2.0
mol·dm-3),沉淀是否溶解?
2.配位溶解法
(1)在AgNO3溶解(0.1
mol·dm-3)中加NaCl溶液(0.1 mol·dm-3),离心分离,在沉淀中加NH3·H2O溶液(2.0 mol·dm-3)至沉淀全部溶解。
(2)分别以KBr溶液(0.1
mol·dm-3)和KI溶液(0.1 mol·dm-3)代替NaCl溶液(0.1
mol·dm-3)并以Na2S2O3溶解(0.1 mol·dm-3)代替NH3·H2O(2.0 mol·dm-3),重复实验2(1)。
(3)在2滴SnCl4溶液(0.1 mol·dm-3)中加入2滴Na2S溶液(0.1 mol·dm-3),有何现象?再多加几滴Na2S,情况又怎样?
(4)用HgCl2溶液(0.1
mol·dm-3)代替SnSO4溶解(0.1 mol·dm-3),重复实验2(3)
3.氧化还原溶解法
(1)取5滴CuSO4溶解(0.1 mol·dm-3)于试管中,加5滴Na2S溶液(0.1 mol·dm-3),有黑色沉淀生成,离心分离,在沉淀中加入2mL HNO3溶液(6.0 mol·dm-3),加热,观察沉淀的溶解。
(2)AgNO3溶液(0.1
mol·dm-3)代替CuSO4溶液(0.1 mol·dm-3),并以HNO3(浓)代替HNO3溶解(6.0 mol·dm-3),重复实验3(1)
4.协同溶解法
(1)在5滴Cd(NO3)2溶液(0.1 mol·dm-3)中加入5滴Na2S溶液(0.1 mol·dm-3),有何现象?离心分离,在沉淀中加入HCl溶液(2.0 mol·dm-3),是否溶解?再加入HCI溶液(6.0 mol·dm-3),又有何现象?
(2)以Pb(NO3)2溶液(0.1 mol·dm-3)代替Cd(NO3)2溶解(0.1 mol·dm-3),并以HCl(浓)代替HCl溶液(6.0 mol·dm-3),重复实验4(1)。
(3)在2支试管中各加入2滴HgCl2溶液(0.1
mol·dm-3)和Na2S溶液(0.1 mol·dm-3),离心分离,弃去清液,在一支试管中加HCl(浓),另一支试管中加HNO3(浓),微热。观察两试管中沉淀是否溶解?小心将两试管液混合,微热,摇荡试管,沉淀溶解否?
5.沉淀转化溶解法
在5滴BaCl2溶液(0.1
mol·dm-3)中加入2滴H2SO4溶液(2.0 mol·dm-3),加水至2mL左右,离心分离,弃去清液,将沉淀用去离子水洗淀2~3次。加入2mL左右Na2CO3溶液(饱和),充分搅拌,离心分离,弃去清液,再用去离子水洗涤沉淀2~3次。加HCl溶液(2.0
mol·dm-3),有何现象?
6.熔融转化溶解法
(1)称取2g α-Al2O3(s)和2g NaOH(s)于铁坩埚内混合均匀后,加热至熔融状态,继续加热1~2分钟后,冷却至室温,用水溶解。
(2)取1g灼烧后的Cr2O3(s)和5g K2S2O7(s)于坩埚混合均匀后,加热至熔融状态,片刻后,冷却至室温,再用水溶解。
思考题
1.按溶解情况,硫化物可分为哪几类?举例说明。
2.解释下列现象:
(1)BaSO4不溶于浓H2SO4,而PbSO4却能溶于H2SO4。
(2)Fe2S3的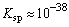 ,CuS ,CuS
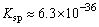 ,前者能溶于稀盐酸,而后者则不溶,为什么? ,前者能溶于稀盐酸,而后者则不溶,为什么?
|