|
一、实验目的
1.掌握水溶液中常见阴离子分离、检出的一般原则、方法,步骤和相应的条件
2.熟悉常见阴离子的有关性质
3.检出未知溶液中的阴离子。
二、实验原理
在水溶液中,非金属元素常以简单阴离子(如S2-,Cl-等)或复杂阴离子(如CO32-,SO42-等)存在。除少数几种阴离子外,大多数情况下阴离子分析中彼此干扰较小,因此阴离子分析一般都采用分别分析(不经过系统分离,直接检出离子)的方法。但是为了搞清楚溶液中离子存在的情况,节省时间,减少分析步骤,进行阴离子系统分析还是有必要的。与阳离子的系统分析不同,阴离子的系统分析的主要目的是应用组试剂来预先检查各组离子是否存在,并不是提供分组把他们系统分离,如果在分组时,已经确定某组离子并不存在,就不必进行该组离子的检出。这样可以简化分析操作过程。
根据阴离子与稀HCl、BaCl2及CaCl2溶液和用稀HNO3酸化过的AgNO3作用,将阴离子分为四组(见表17-1):
表17-1 阴离子分组
|
组别
|
构成各组的阴离子
|
组试剂
|
特性
|
|
第一组
(挥发组)
|
S2-、SO32-、S2、CO32-、NO2-等离子
|
HCl
|
在酸性介质中不稳定,易形成挥发性酸或易分解的不稳定的酸
|
|
第二组
(钙、钡盐组)
|
SO42-、PO43-、SiO32-、AsO43-等离子
|
BaCl2中性或弱碱性介质
|
钙盐、钡难溶于水
|
|
第三组
(银盐组)
|
Cl-、Br-、I-等离子
|
AgNO3
HNO3
|
银盐难溶于水及稀硝酸
|
|
第四组
(易溶组)
|
NO3-、ClO3-、CH3COO-等离子
|
无组试剂
|
银盐、钡盐、钙盐等均易溶于水
|
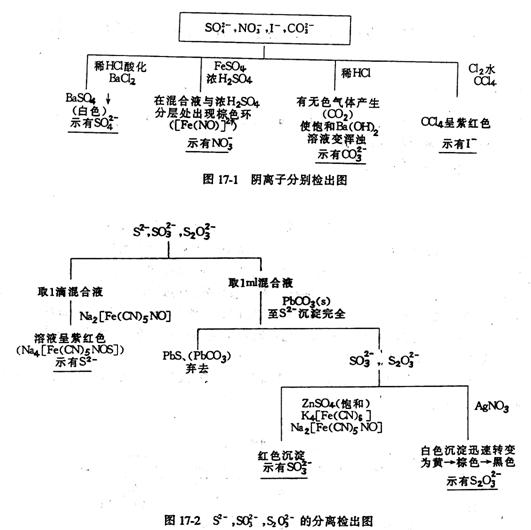
在定性分析阴离子混合液时,我们可以根据试液组分的复杂程度,有效的拟定分离检出的实验方案,对于已知离子混合液的分析,可以根据离子的性质拟定方案,若混合液中各离子间在检出时无干扰,可以进行分别分析,例如含有SO42、NO3-、I-、CO32-混合液的定性分析就可以采用分别分析法,其分析过程可以简图列出(见图17-1):
若混合溶液中存在的各种离子之间在检出时有干扰,则应根据具体情况拟定合理的分析方案,例如S2-、SO32-和S2混合液的分离与捡出,其分析过程(见图17-2):
对于未知试样往往采用以下分析方法,其分析步骤如下:
(1)阴离子的初步检验
a.溶液酸碱性的检验,用pH试纸测定未知液的酸碱性。如果溶液呈强酸性,则不可能存在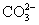 、 、 、S2-、 、S2-、 、 、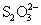 ,如有 ,如有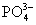 ,也只能是以H3PO4形式存在。 ,也只能是以H3PO4形式存在。
如果试液是碱性,在试液中加入3mol·dm-3
H2SO4酸化,稍微加热,观察有无气泡生成;若有气泡生成,表示可能有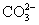 、S2-、 、S2-、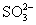 、 、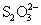 、 、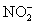 (若所含离子浓度不高时,就不一定观察到明显的气泡)。 (若所含离子浓度不高时,就不一定观察到明显的气泡)。
b.钡组阴离子的检验在试液中加入6mol·dm-3的NH3·H2O,使溶液呈碱性,然后加入1.0mol·dm-3
BaCl2溶液,若有白色沉淀生成,则可能含有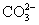 、S2-、 、S2-、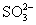 、 、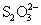 、 、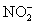 (浓度大于0.04mol·dm-3时);如不能产生白色沉淀,则这些离子不存在( (浓度大于0.04mol·dm-3时);如不能产生白色沉淀,则这些离子不存在(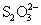 不能确定)。 不能确定)。
c.银组阴离子的检验,取未知液3~4滴,加入数滴0.1mol·dm-3
AgNO3溶液,如果立即生成黑色沉淀,表示有S2-存在,如果生成白色(或黄色)沉淀,且沉淀迅速变黄 棕 棕 黑,表示有 黑,表示有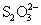 存在,离心分离,在沉淀中加入一定量6mol·dm-3 HNO3(必要时加热搅拌),若沉淀不溶或部分溶解,表示可能有Cl-、Br-、I-存在。如果溶液中间同时存在Cl-、Br-、I-,则对这三种离子分别检出有干扰,这时应对这三种离子分离,再分别检出,其分离过程可以简示如(图17-3): 存在,离心分离,在沉淀中加入一定量6mol·dm-3 HNO3(必要时加热搅拌),若沉淀不溶或部分溶解,表示可能有Cl-、Br-、I-存在。如果溶液中间同时存在Cl-、Br-、I-,则对这三种离子分别检出有干扰,这时应对这三种离子分离,再分别检出,其分离过程可以简示如(图17-3):
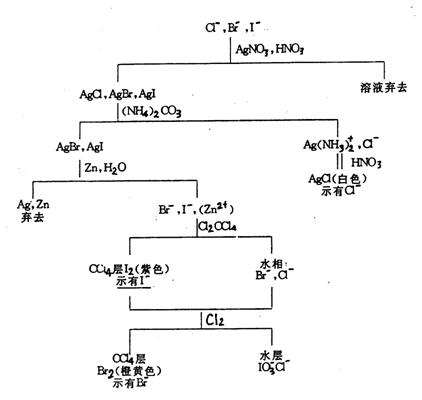
图17-3 Cl-、Br-、I-的分离检出流程图
d.还原性阴离子的检验,用3mol·dm-3
H2SO4使试液酸化,加入数滴KMnO4溶液,若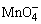 的紫红色褪去,表示可能有 的紫红色褪去,表示可能有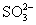 、 、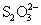 、S2-、Br-、I-、 、S2-、Br-、I-、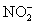 等还原性离子存在。相应的反应方程如下: 等还原性离子存在。相应的反应方程如下:
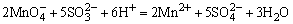
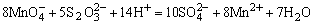
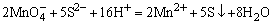
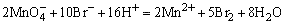
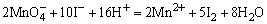
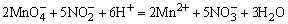
检出还原性离子后,再用淀粉-碘溶液进一步检验是否存在强还原性离子,若加入淀粉-碘溶液后,蓝色褪去,表示可能存在S2-、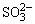 、 、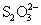 等离子。相应的反应方程式如下: 等离子。相应的反应方程式如下:
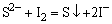
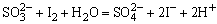
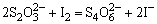
e.氧化性阴离子的试验,在用H2SO4酸化后的试液中加入CCl4和1~2滴1mol·dm-3
KI溶液,振荡试管,如果CCl4层呈紫色,表示溶液中存在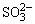 。 。
根据以上初步试验,可以判断哪些离子可能存在,把结果填入表17-2中:
(2)阴离子的确证性试验
经过初步实验,可以判断哪些离子可能存在,哪些离子不可能存在,对可能存在的阴离子,利用阴离子的特征反应一一进行分离检出,最后确定溶液中有哪些阴离子。常见阴离子的检出反应:
1.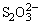 的检出 试液用HCl酸化,在所得清液中加入BaCl2溶液,生成白色BaSO4沉淀,表示有 的检出 试液用HCl酸化,在所得清液中加入BaCl2溶液,生成白色BaSO4沉淀,表示有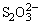 存在,钡组其它离子不干扰。反应方程式如下: 存在,钡组其它离子不干扰。反应方程式如下:
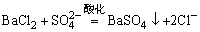
2. 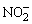 的检出,检测时 的检出,检测时 和 和 有干扰,消除干扰的方法是在试液酸化前加4-6滴3% H2O2,消除干扰离子后,在试液中加入等体积3mol·dm-3
HCl,立即用附有滴管(滴管中盛有1~2滴澄清的饱和Ba(OH)2溶液)的软木塞将试管口塞紧,如有气泡发生,并使Ba(OH)2溶液变混蚀,示有 有干扰,消除干扰的方法是在试液酸化前加4-6滴3% H2O2,消除干扰离子后,在试液中加入等体积3mol·dm-3
HCl,立即用附有滴管(滴管中盛有1~2滴澄清的饱和Ba(OH)2溶液)的软木塞将试管口塞紧,如有气泡发生,并使Ba(OH)2溶液变混蚀,示有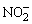 离子。反应方程式如下: 离子。反应方程式如下:
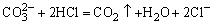
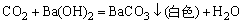
表17-2 阴离子初步试验
|
试验
项目
试验
结果
阴离子
|
pH
试验
|
稀H2SO4试 验
|
还原性阴离子试验
|
氧化性
阴离子
试 验
|
BaCl2
试验
|
AgNO3
试验
|
综合分析
|
|
KMnO4
(酸性)
|
淀粉-碘
|
|
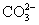
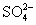
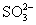
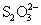
S2-
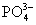
Cl-
Br-
I-
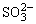
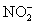
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.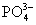 的检出 取4滴试液,加入浓HNO3 3~4滴,煮沸,将还原性阴离子氧化,以消除干扰离子的干扰,再加钼酸铵试剂8~10滴,微热,用玻棒摩擦试管内壁,生成黄色晶沉淀示有 的检出 取4滴试液,加入浓HNO3 3~4滴,煮沸,将还原性阴离子氧化,以消除干扰离子的干扰,再加钼酸铵试剂8~10滴,微热,用玻棒摩擦试管内壁,生成黄色晶沉淀示有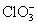 离子。反应方程式如下: 离子。反应方程式如下:
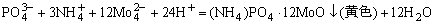
4.S2-的检出,取1滴碱性试液于点滴板中,加入1滴1%亚硝酰铁氰化钠试剂,溶液变为紫色,示有S2-离子。反应方程式如下:
5.
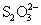 的检出 在与干扰离子分离后,加入过量的AgNO3,白色沉淀很快变为棕色,最后变成黑色,示有 的检出 在与干扰离子分离后,加入过量的AgNO3,白色沉淀很快变为棕色,最后变成黑色,示有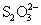 离子。反应方程式如下: 离子。反应方程式如下:
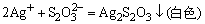
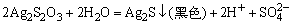
6.
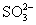 的检出,在点滴板上加入饱和ZnSO4溶液和0.1mol·dm-3 K4Fe(CN)6各1滴和2mol·dm-3的NH3·H2O
1滴,生成红色沉淀,示有 的检出,在点滴板上加入饱和ZnSO4溶液和0.1mol·dm-3 K4Fe(CN)6各1滴和2mol·dm-3的NH3·H2O
1滴,生成红色沉淀,示有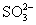 。硫化物对此反应有干扰,应先除去干扰离子。(反应机理不详)。 。硫化物对此反应有干扰,应先除去干扰离子。(反应机理不详)。
7.Cl-、Br-、I-的分离与检出,前面已经述及,此处从略。
8.
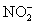 的检出,取数滴试液加入0.5ml KI溶液和一定量CCl4,用H2SO4酸化,摇动试管,CCl4层呈紫色,示有 的检出,取数滴试液加入0.5ml KI溶液和一定量CCl4,用H2SO4酸化,摇动试管,CCl4层呈紫色,示有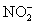 离子。反应方程如下: 离子。反应方程如下:
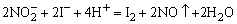
9.
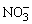 的检出,在点滴板中加入1滴试液和一小粒FeSO4·7H2O晶体,然后沿晶体边缘滴加浓H2SO4
1滴,在FeSO4晶体四周形成棕色圆环,示有 的检出,在点滴板中加入1滴试液和一小粒FeSO4·7H2O晶体,然后沿晶体边缘滴加浓H2SO4
1滴,在FeSO4晶体四周形成棕色圆环,示有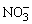 离子, 离子,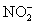 有干扰,用尿素和H2SO4加热,可以消除 有干扰,用尿素和H2SO4加热,可以消除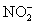 的干扰。反应方程式如下: 的干扰。反应方程式如下:
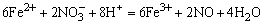
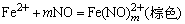
三、仪器与药品
含有常见阴离子的混合试液,含有S2-、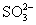 、 、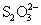 和 和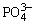 的混合溶液,Cl-、Br-、I-的混合试液。 的混合溶液,Cl-、Br-、I-的混合试液。
H2SO4(浓、3mol·dm-3)
HCl(2、6 mol·dm-3)
HNO3(浓、2、6
mol·dm-3)
Ba(OH)2饱和溶液
BaCl2(1.0
mol·dm-3)
(NH4)2CO3溶液12%
(NH4)2MoO4溶液,3%
AgNO3(0.1 mol·dm-3)
ZnSO4(饱和溶液)
K4[Fe(CN)6](0.1 mol·dm-3)
Na2[Fe(CN)5NO] 1%
FeSO4·7H2O(s)
PbCO3(s) 尿素(s) Zn粉 CCl4
H2O2
3% 氯水(饱和溶液)
pH试纸
NH3·H2O(2、6
mol·dm-3) KMnO4(0.02
mol·dm-3)
淀粉-碘溶液
KI溶液(0.5 mol·dm-3)
离心机 水浴 带塞的滴管
四、实验内容
(一)已知阴离子混合液的分离与检出
分离与检出下列两组阴离子混合液
1.Cl-、Br-、I-的混合液
2.S2-、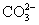 、 、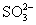 、 、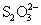 、 、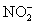 混合液 混合液
(二)未知阴离子混合液的分析
取一份混合溶液(其中可能含有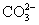 、S2-、 、S2-、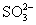 、 、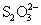 、 、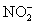 、Cl-、Br-、I-等离子),自行拟定初步试验和各个离子确证性试验的实验方案,并检出未知混合溶液中含有哪些阴离子。 、Cl-、Br-、I-等离子),自行拟定初步试验和各个离子确证性试验的实验方案,并检出未知混合溶液中含有哪些阴离子。
五、预习内容
1.查阅有关参考书目(同实验十八),了解常见阴离子的性质,检出反应方程式以及离子的干扰情况。
2.拟定两组已知阴离子混合溶液的分析方案。
3.拟定未知混合溶液的分析方案。
4.离心机的使用方法,水浴加热的操作,固液分离的操作。
六、思考题
1.某碱性无色未知溶液,用HCl溶液酸化后变混,此未知溶液中可能有哪些阴离子?
2.请选用一种试剂区别下列5种溶液
NaNO3 Na2S NaCl Na2S2O3 Na2HPO4
3.在用淀粉-碘溶液检验未知液中有无强还原性阴离子时,为什么要把未知液调至近中性。
4.哪些离子干扰PO43-的检出,怎样消除?
5.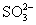 的存在为什么干扰 的存在为什么干扰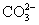 的鉴定,如何消除? 的鉴定,如何消除?
参考文献同实验十八
|