一、实验目的
1.了解测定铁矿石中铁含量的标准方法和基本原理。
2.学习矿样的分解,试液的预处理等操作方法。
3.初步了解测定矿物中某组分的含量的基本过程以及相应的实验数据的处理方法。
二、实验原理
含铁的矿物种类很多。其中有工业价值可以作为炼铁原料的铁矿石主要有:磁铁矿(Fe3O4)、赤铁矿(Fe2O3)、褐铁矿(Fe2O3·nH2O)和菱铁矿(FeCO3)等。测定铁矿石中铁的含量最常用的方法是重铬酸钾法。经典的重铬酸钾法(即氯化亚锡-氯化汞-重铬酸钾法),方法准确、简便,但所用氧化汞是剧毒物质,会严重污染环境,为了减少环境污染,现在较多采用无汞分析法。
本实验采用改进的重铬酸钾法,即三氯化钛-重铬酸钾法。其基本原理是:粉碎到一定粒度的铁矿石用热的盐酸分解:
Fe2O3+6H+ 2Fe3++3 H2O
2Fe3++3 H2O
试样分解完全后,在体积较小的热溶液中,加入SnCl2将大部分Fe3+还原为Fe2+,溶液由红棕色变为浅黄色,然后再以Na2WO4为指示剂,用TiCl3将剩余的Fe3+全部还原成Fe2+,当Fe3+定量还原为Fe2+之后,过量1~2滴TiCl3溶液,即可使溶液中的Na2WO4,还原为蓝色的五价钨化合物,俗称:“钨蓝”,故指示溶液呈蓝色,滴入少量K2Cr2O7,使过量的TiCl3氧化,“钨蓝’刚好褪色。在无汞测定铁的方法中,常采用SnCl2-TiCl3,联合还原,其反应方程式为:
2Fe3++Sn3+=Sn4+Fe2+
Fe3++Ti3++H2O=
Fe2++TiO2++2H+
此时试液中的Fe3+已被全部还原为Fe2+,加入硫磷混酸和二苯胺磺酸钠指示剂,用标准重铬酸钾溶液滴定至溶液呈稳定的紫色即为终点,在酸性溶液中, 滴定Fe2+的反应式如下:
滴定Fe2+的反应式如下:
+6Fe2++14H+=6Fe2++2Cr3++7H2O
黄色 绿
在滴定过程中,不断产生的Fe3+(黄色)对终点的观察有干扰,通常用加入磷酸的方法,使Fe3+与磷酸形成无色的Fe(HPO4)2-配合物,消除Fe3+(黄色)的颜色干扰,便于观察终点。同时由于生成了Fe(HPO4)2-,Fe3+的浓度大量下降,避免了二苯磺酸钠指示剂被Fe3+氧化而过早的改变颜色,使滴定终点提前到达的现象,提高了滴定分析的准确性。
由滴定消耗的K2Cr2O7溶液的体积(V),可以计算得到试样中铁的含量,其计算式为:
Fe的含量(Fe%)=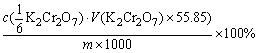
式中 为
为 标准溶液的物质的量浓度/mol·dm-3,m为试样的质量/g,55.85为铁在滴定反应中的摩尔质量/g·mol-1。
标准溶液的物质的量浓度/mol·dm-3,m为试样的质量/g,55.85为铁在滴定反应中的摩尔质量/g·mol-1。
三、仪器与药品
分析天平;酸式滴定管;锥形瓶(250ml);电热板或电炉;
标准溶液 ;HCl溶液1+1;SnCl2溶液(10%):称取100g SnCl2·2H2O,溶于500cm3盐酸中,加热至澄清,然后加水稀释至1dm3。
;HCl溶液1+1;SnCl2溶液(10%):称取100g SnCl2·2H2O,溶于500cm3盐酸中,加热至澄清,然后加水稀释至1dm3。
Na2WO4溶液(10%):称取l00g Na2WO4,溶于约400ml蒸馏水中,若浑浊则进行过滤,然后加入50ml H3PO4,用蒸馏水稀释至1dm3。
TiCl3溶液(1+9):将100cm3 TiCl3试剂(15%~20%)与HCl溶液(1+1) 200cm3及700cm3水相混合,转于棕色细口瓶中,加入10粒无砷锌,放置过夜。
硫磷混合液,在搅拌下将200cm3 H2SO4缓缓加到500ml中,冷却后再加300cm3 H3PO4混匀。
KMnO4溶液:1%
二苯胺磺酸钠溶液:0.5%。
四、实验内容
1.试样的分解
用分析天平准确称取0.2g铁矿石试样3份,分别置于3个250cm3,锥形瓶中,用少量蒸馏水搁湿,加入20cm3 HCl溶液,盖上表面皿,小火加热至近沸,待铁矿大部分溶解后,缓缓煮沸1~2min,以使铁矿分解完全(即无黑色颗粒状物质存在),这时溶液呈红棕色。用少量蒸馏水吹洗瓶壁和表面皿,加热至沸。
试样分解完全后,样品可以放置。用SnCl2还原Fe3+至Fe2+时,应特别强调,要预处理一份就立即滴定,而不能同时预处理几份并放置,然后再一份一份的滴定。
2.Fe3+的还原
趁热滴加10%SnCl2溶液,边加边摇动,直到溶液由红棕色变为浅黄色,若SnCl2过量,溶液的黄色完全消失呈无色,则应加入少量KMnO4溶液使溶液呈浅黄色。加入50cm3蒸馏水及10滴l0%Na2WO4溶液,在摇动下滴加TiCl3溶液至出现稳定的蓝色(即30秒内不褪色),再过量1滴。用自来水冷却至室温,小心滴加K2Cr2O7溶液至蓝色刚刚消失(呈浅绿色或接近无色)。
3.滴定
将试液再加入50cm3蒸馏水,10cm3硫磷混酸及2滴二苯胺磺酸钠指示剂,立即用K2Cr2O7标准溶液滴定至溶液呈稳定的紫色为终点;记下所消耗的K2Cr2O7标准溶液的体积。按照上述步骤测定另二份样品。
4.计算结果,根据所耗K2Cr2O7标准溶液的体积,按公式计算铁矿中帙的含量(%)。三次平行测定结果的极差应不大于0.4%,以其平均值为最后结果。
五、预习要求
1.误差及有效数据。
2.分析天平的使用,酸式滴定管的使用,固体试样的分解。
六、思考题
1.简述三氯化钛-重铬酸钾法测定铁含量的原理,写出相应的反应方程式。
2.滴定前为什么要加入硫磷混酸?
3.还原Fe3+时,为什么要使用两种还原剂,只使用其中的一种有何不妥?
4.试样分解完,加入硫磷混合酸和指示剂后为什么必须立即滴定?