|
一、钢铁表面的磷化处理
1.提要
钢铁的磷化处理是防锈的一种有效措施,本文简单介绍了钢铁的磷化工艺。
钢铁制件在一定条件下,经磷酸盐水溶液处理后,表面上能形成一层磷酸盐保护膜,简称磷化膜。此膜疏松、多孔,具有附着力强、耐蚀性和绝缘性好等特点,可以作为良好的涂漆底层和润滑层。所以磷化处理被广泛地应用于汽车、家用电器和钢丝拉拔等工业部门。按磷化液主成份的不同,有磷酸锰盐、磷酸铁盐和磷酸锌盐等类型的磷化液;按磷化方式不同,有浸渍、喷射和涂刷等磷化方式[1]。为了获得性能良好的磷化膜和改进磷化工艺,目前国内外仍将磷化作为重要课题加以研究。
磷酸锌盐磷化液的基本原料是工业磷酸、硝酸和氧化锌。可以按一定比例直接配成磷化液,也可以先制成磷酸二氢锌和硝酸锌浓溶液,再按一定比例加水配成磷化液。磷化处理的一般过程是:(钢件)→除油→水洗→酸洗→水洗→磷化→水洗→涂漆。除油可采用金属清洗剂在常温下进行,水洗时如表面不挂水珠,则表示除油彻底。酸洗液可用20% H2SO4洗到铁锈除净为止,酸洗温度过高或时间过长,会产生过腐蚀现象,应当避免。各水洗过程都用自来水,最好采用淋洗。
2.实验部分
(1)试片的预处理
试片为85×25×0.80(mm)普通碳素钢片。经除油、酸洗和水洗后放在清水中备用(时间不宜过长,否则易生锈),操作时用镊子夹取试片。
(2)磷化液的配制
称量4.0g Zn(99.5%)放人100dm3烧杯中,加10mL自来水润透,用玻璃棒搅成糊状。将烧杯放在石棉网上,加8.5mL HNO3(45%)和1.8mL H3PO4(85%),边加边搅拌,使固体基本溶解。将溶液倒入100dm3量筒中,加水稀释至100mL,配成磷化液。
(3)试片的磷化
把磷化液倒入烧杯中,搅拌均匀,用pH试纸测酸度(pH≈2)。将烧杯放在恒温槽中加热至50±1℃,取一试片浸在磷化液中,并计时,5分钟时取出,用水冲掉表面上的磷化液,将试片放在支架上自然干燥(15分钟左右)。若磷化膜外观呈银灰色,连续、均匀、无锈迹,说明磷化效果较好。(可重复磷化3~5片)
(4)磷化膜耐蚀性的检验
选择已干燥的磷化好的试片,滴一滴硫酸铜试液于磷化膜上,记录该处出现红棕色的时间,若接近或超过一分钟为合格。
硫酸铜点滴试液的组成:40dm3 CuSO4溶液(1.0mol·dm-3)加0.8dm3
NaCl溶液(0.1mol·dm-3)和20dm3 HCl溶液(10%)。
3.结果与讨论
(1)磷化过程包含着复杂的化学反应,涉及离解、水解、氧化还原、沉淀和配位反应等。
离解: Zn(NO3)2®Zn2++2NO3- (1)
Zn(H2PO4)2®Zn2++2H2PO4- (2)
H2PO4-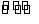 HPO42-+H+
(K2≈10-8) (3) HPO42-+H+
(K2≈10-8) (3)
HPO4-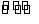 PO43-+H+
(K3≈10-13) (4) PO43-+H+
(K3≈10-13) (4)
水解: Zn2++H2O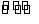 Zn(OH)++H+ (Kh≈10-10) (5) Zn(OH)++H+ (Kh≈10-10) (5)
PO43-+ H2O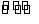 HPO42-+OH- (Kh1≈10-1) (6) HPO42-+OH- (Kh1≈10-1) (6)
HPO42-+H2O
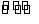 H2PO4-+OH-
(Kh2≈10-6) (7) H2PO4-+OH-
(Kh2≈10-6) (7)
H2PO4-+H2O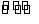 H3PO4+OH- (Kh3≈10-11) (8) H3PO4+OH- (Kh3≈10-11) (8)
由于磷化液的pH值在2左右,Zn2+的水解可以忽略。但磷酸根离子的水解比较显著,磷化液中PO43-的浓度极小,即:c(Zn2+)>>c(H+)≈c(H2PO4-)>c(HPO42-)>>c (PO43-)
(2)磷化时,在钢铁表面上同时发生两类化学反应:
氧化还原: Fe+2H+=Fe2++H2(g) (9)
3Fe+2NO3-+8H+=3Fe2++2NO(g)+4H2O (10)
3H2+2NO3-+2H+=2NO(g)+4H2O (11)
反应(9),(10)是钢铁的腐蚀;反应(11)是NO3-的去氢气作用,以保证磷化的正常进行。
沉淀反应: Fe2++HPO42-+=FeHPO4
(s) (12)
3Zn2++2
PO43-=Zn3(PO4)2(s) (13)
伴随(9),(10)反应的进行,在相界面处H+的浓度逐渐下降,pH值升高;Fe2+浓度逐渐增大,当c(Fe2+)·c(HPO42-)≥Kap(FeHPO4)和[c(Zn2+)]2≥Kap[Zn3(PO4)2]时,钢铁表面上将发生(12)、(13)反应。有人认为[2],早期生成的磷化膜的铁含量高,磷酸铁盐小晶粒是磷酸锌盐沉淀的基础,磷化膜的主要成分是FeHPO4和Zn3(PO4)2。
(3)磷化继续进行时,磷化液中还会发生下列反应:
[Fe(H2O)6]2++NO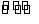 [Fe(NO)(H2O)5]2++H2O (14) [Fe(NO)(H2O)5]2++H2O (14)
3Fe2++NO3-+4H+®3Fe3++NO(g)+2H2O (15)
Fe3++PO43-®FePO4(s) (白色) (16)
因此可以看到磷化液由无色透明渐渐变成浅棕色,继而溶液混浊并产生白色沉淀。
(4)影响磷化质量的诸因素[3]
钢铁种类及其表面状态、磷化温度和时间、以及磷化液中杂质离子的含量都对磷化质量有影响,这些因素之间是相互制约的,分析问题时应全面考虑。磷化液配方和工艺条件的确定,可通过正交试验方法进行优选。
4.参考文献
[1] 韩熙麟、姜英涛编,《轻工产品涂装技术》,上海科学技术出版社,1983年。
[2]《钢铁的磷化机理》,加拿大魁北克省Laval大学金相系Edward.L.Ghal.R.I.A.Poerin (1980)。
[3]《表面处理》编写组编,《表面处理》(下册),国防工业出版社,1973年。
*二、防锈颜料磷酸锌的制备
本文介绍了制备防锈颜料磷酸锌的一种方法。
磷酸锌是一种新型防锈颜料,利用它可配制各种防锈涂料,以此代替氧化铅作为底漆,可简化防锈工艺,避免铅中毒。
1.实验部分
在不断搅拌下将称得的2.44gZnO(s)粉末加入盛有助80℃热水的50ml小烧杯中,连续搅拌20分钟制成20%的糊状混合物,冷却之,称取1.9g H3PO4(85%)配成H3PO4溶液(15%),逐滴加到糊状物中,边加边搅拌10分钟后,放置之,令其自然结晶,然后再搅拌5分钟。如果反应已基本完成,则溶液的pH值当在5~6左右,将晶体用水洗涤,直至洗涤水接近中性,然后抽滤。分离出产品在110℃左右烘干并研细、称重、计算百分产率。
产品应为比较疏松的白色粉末,含Zn量应大于44%。
2.讨论
制备磷酸锌有几种方法,可由磷酸盐(Na3PO4,Na2HPO4)和锌盐进行复分解反应,或由锌盐在碱性条件下与磷酸反应,也可由锌的氧性物或氢氧化物与磷酸直接反应而制得。本实验采用ZnO(s)与H3PO4溶液直接反应制取,反应方程式为:
3ZnO(s)+
2H3PO4(1)®Zn3(PO4)2(s)+3H2O(1)
此反应制取的是Zn3(PO4)2·4H2O,而用作颜料的是Zn3(PO4)2·2H2O,因此,在制得四水合晶体后须在100~110℃左右烘箱中脱水使之成为二水合晶体。
|