一、实验目的
1.合成化学发光材料鲁米诺(Luminol)。
2.观察在不同条件下的化学发光现象,了解催化剂、酸度和温度对化学发光现象的影响。
3.分析比较生物酶和金属离子对化学发生反应的催化效率。
二、实验原理
剧烈的化学反应常同时伴随有热和光的产生,光的产生通常和体系在高温时的辐射有关,往往温度不同,光色也不同。另有一类化学反应,可以通过分子的被激发(由基态变为能量较高的激发态)和驰豫(由激发态回到基态)将反应中释放的能量大部分变为光能,而体系的温度变化不大,这种现象叫做化学发光现象。夏夜庭院中飞舞的萤火虫所发的光就其本质而言,也属于化学发光现象(Chemiluminescence)。化学发光现象已获得广泛的应用,除用作紧急光源、信号光源外,有关的反应已用地灵敏度极高的光化学分析中。
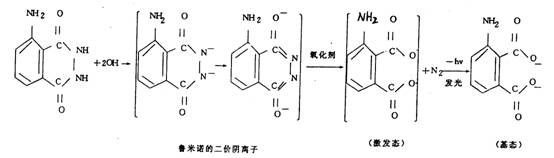
3-氨基邻苯二甲酰肼(又称鲁米诺),是一种较强的化学发光物质,在中性溶液中通常以偶极离子(两性离子)存在。在碱性溶液中,则变成二价负离子,并可被氧分子氧化成一种能产生化学发光现象的中间体。在氧化剂中,鲁米诺被转换为激发态,激发态衰变为基态并发出荧光,发光反应式见下面。
如溶液中混有适当的荧光染料,在鲁米诺本身发光之前,若鲁米诺中间体可将能量传递给染料,则可调整发光的颜色。
|
所加荧光染料
|
/
|
荧光素
|
二氯荧光素
|
罗丹明B
|
9-氨基吖啶
|
曙红
|
|
呈现的颜色
|
蓝白
|
黄绿
|
黄橙
|
绿
|
蓝绿
|
橙红
|
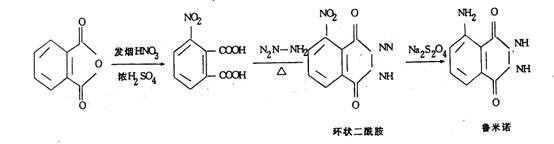
鲁米诺的合成是通过邻苯二甲酸酐硝化制得3-硝基邻苯二甲酸,随后与肼反应生成黄色的环状二酰胺,再经连二亚硫酸钠Na2S2O4还原得到鲁米诺。
由于时间关系,鲁米诺的合成只做最后一步。
三、仪器、试剂
仪器:试管(20cm3,3支;10cm3,3支),试管夹,油浴或酒精灯,烧杯(100cm3 ,1个),锥形瓶(100cm3,2个)量筒(50cm3,10cm3各1个)、滴管2支、玻璃棒、台秤、80-2型离心沉淀机
试剂:粒状NaOH,10%NaOH,10%H2O2,二甲亚砜,染料,铁氰化钾晶体,连二亚硫酸钠粉末,冰醋酸,浓H2SO4,0.1mol/dm3 NaOH,
0.1mol/dm3铁氰化钾,Tris缓冲液,0.9%过氧化物酶。
四、实验内容
1.鲁米诺的合成
在20cm3试管中,加入0.3g环状二酰胺,用5cm3 10%NaOH溶解,加入2g连二亚硫酸钠粉末,用玻璃棒充分搅匀,在通风柜内,将试管放入油浴中,加热至沸点,保温15min(或用酒精灯的微火小心加热至沸腾,试管距火焰高些,保温加热,并不断摇晃,千万不可喷出!沸腾15min),加入冰醋酸2cm3。将试管自然冷却至室温,再在冷水浴中冷却10min,逐渐析出棕黄色鲁米诺固体,离心分离,用滴管取出上层清液,得产物鲁米诺约0.3g。
2.化学发光实验(在暗处观察)
(1)在100cm3锥形瓶底部铺上约10粒粒状NaOH,用玻璃棒蘸出1/3鲁米诺,并加8cm3二甲砜剧烈振荡,使空气溶入溶液中,在暗处可观观察到蓝白色光辉。向上述体系中加入5cm3 10%H2O2后继续振荡,2~3min后可以看到发光强度很快增加。
(2)在100cm3烧杯中加入60cm3水,再加8粒NaOH,5cm310%的H2O2和1/3鲁米诺,将一小片滤纸放在溶液的表面,小心放上少量铁氰化钾晶体,仔细的摇动,让少量晶体掉入溶液,或沿烧杯壁轻轻撒入少量铁氰化钾晶体,观察发光现象,再加入3滴染料溶液,观察颜色的变化。
A.将以上溶液部分倒入1支10cm3试管中,逐滴加入5~10滴浓H2SO4,观察酸度对化学化光的影响。
B.再将以上溶液部分倒入两支10cm3试管中,分别放入冰(冷)水及热水浴中对比观察,了解温度对化学发光现象的影响。
(3)在锥形瓶中,加入30cm3 0.1mol/dm3
NaOH溶液和剩余的鲁米诺,滴加3滴10%H2O2后即可观察到微弱的发光。将上述体系均匀分入两支20ml试管中,分别加入4滴铁氰化钾和过氧化物酶溶液,均可观察到持续几秒钟的强光发射,比较生物酶和金属离子对化学发光反应的催化效率。
五、思考题
1.鲁米诺合成也是在碱性条件下进行,为什么生成的鲁米诺不会发光?
2.试分析鲁米诺发光的影响因素?
3.在生物体中,过氧化物可催化产生H2O2,试分析用化学发光测定过氧化物酶活性的原理。