|
一、实验目的
1.了解离子交换法净化水的原理与方法。
2.了解用配合滴定法测定水的硬度的基本原理和方法。
3.进一步练习滴定操作及离子交换树脂和电导率仪的使用方法。
二、实验原理
1.硬水和水的硬度
通常将溶有微量或不含Ca2+、Mg2+等离子的水叫做软水,而将溶有较多量Ca2+、Mg2+等离子的水叫做硬水。水的硬度是指溶于水中的Ca2+、Mg2+等离子的含量。水中所含钙、镁的酸式碳酸盐经加热易分解而析出沉淀,由这类盐所形成的硬度称为暂时硬度。而由钙、镁的硫酸盐、氯化物、硝酸盐所形成的硬度称为永久硬度。暂时硬度和永久硬度的总和称为总硬度。
硬度有多种表示方法。例如,以水中所含CaO的浓度(以m mol·dm-3为单位)表示,也有以水中含有CaO的ppm(即每立方分米水中所含CaO的毫克数)表示。水质可按硬度的大小进行分类,如表24-1所示。
表24-1 水质的分类
|
水质
|
水的总硬度
|
|
CaO/(mg·dm-3)*
|
CaO/( m mg·dm-3)
|
|
很 软 水
软 水
中等硬水
硬 水
很 硬 水
|
0~40
40~80
80~160
160~300
>300
|
0~0.72
0.72~1.4
1.4~2.9
2.9~5.4
>5.4
|
*也有用度(°)表示硬度,即每dm3水中含10mg CaO为1度。1°=10ppm
2.水的硬度的测定原理
水的硬度的测定方法甚多,最常用的是edta配合滴定法(利用配合反应进行滴定的方法)。Edta 乙二胺四乙酸根离子

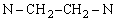 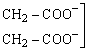
的缩写。乙二胺四乙酸可用H4edta表示,实验室中通常用其二钠盐(Na2H2edta)配制溶液。
在测定过程中,控制适当的pH值,用少量铬黑T(C20H12O7N3SNa,可缩写为NaH2ebt)作指示剂,水样中的少量Mg2+、Ca2+能与其反应,分别生成紫红色的配离子[Mg(ebt)]-和[Ca(ebt)]-,但其稳定性不及与edta所形成配离子[Mg(edta)]2-和[Ca(edta)]2-。上述各配离子的lgKf值及颜色见表24-2
表24-2 一些钙、镁配离子的1gKf值和颜色
|
配离子
|
[Ca(edta)]2-
|
[Mg(edta)]2-
|
[Mg(ebt)]-
|
[Ca(ebt)]-
|
|
1gkf
|
11.0
|
8.46
|
7.0
|
5.4
|
|
颜色
|
无色
|
无色
|
紫红色
|
紫红色
|
滴定时,edta先溶液中未配合的Ca2+、Mg2+结合,然后与[Mg(ebt)]-、[Ca(ebt)]-反应,从而游离出指示剂edt,使溶液颜色由紫红色变为蓝色,表明滴定达到终点。这一过程可用化学反应式表示(式中Me2+表示Ca2+或Mg2+):
Hedt2-(aq)+Me2+(aq) [Me(ebt)]-+H+(aq) [Me(ebt)]-+H+(aq)
蓝色
紫红色
[Me(ebt)]- +H2edta2-
(aq)+OH-(aq)=[Me(edta)]2-+Hebt2-(aq)+H2O(1)
紫红色 无色
无色 蓝色
根据下式可算出水样的总硬度。
总硬度/(m mol·dm-3)=1000c(edta)·V(edta)/V(H2O)
或 总硬度/ppm=1000c(edta)·V(edta)·M(CaO)/V(H2O)
式中:c(edta)——标准Na2H2edta溶液的浓度(mol·dm-3);
V(edta)——滴定中消耗的标准Na2H2edta溶液体积(cm3);
V(H2O)——所取待测水样的体积(cm3);
M(CaO)——CaO的摩尔质量(g·mol-1)。
3.水的软化和净化处理
硬水的软化和净化的方法很多,本实验采用离子交换法。使水样中的Ca2+、Mg2+等离子与正离子交换树脂进行正离子交换,交换后的水即为软化水(简称软水);若使水样中的正、负离子与正、负离子交换树脂进行离子交换,可除把去水样中的杂质正、负离子而使水净化,所得的水叫做去离子水。化学反应式可表示如下(以杂质离子Mg2+和C1-为例):
2R-SO3H(S)+Mg2+(aq)=(R-SO3)2Mg(S)+2H+(aq)
2R-N(CH3)3OH(S)+2Cl-(aq)=2R-N(CH3)3Cl(S)+2OH-(aq)
H+(aq)+OH-(aq)=H2O(1)
4.水的软化和净化检验
水中的微量Ca2+、Mg2+,可用铬黑T指示进行检验。在pH=8~11的溶液中,铬黑T能与Ca2+、Mg2+作用生成紫红色的配离子。
纯水是一种极弱的电解质,水样中所含有的可溶性电解质(杂质)常使其导电能力增大。用电导率仪测定水样的电导率,可以确定去离子水的纯度。各种水样的电导率值大致范围见表24-3。
表24-3 各种水的电导率
|
水样
|
电导率/(S·m-1)
|
|
自 来 水
一般实验室用水
去离子水
蒸 馏 水
最 纯 水
|
5.0×10-1~5.3×10-2
5.0×10-3~1.0×10-4
4.0×10-4~8.0×10-5
2.8×10-4~6.3×10-6
~5.5×10-6
|
三、仪器和药品
1.仪器
常用仪器:微型离子变换柱(套) 烧杯(100cm3 2只250cm3)锥形瓶(250cm3 2只)铁台 螺丝夹 滴管 移液管(100cm3) 吸气橡皮球 碱式滴定管(50cm3) 滴定管夹 白瓷板 量筒10cm3,4只;50cm3 洗瓶 玻璃棒 滤纸(或滤纸片)棉花 T形管 乳胶管 6孔井穴板
其他:电导率仪(附铂黑电极和铂光亮电导电极)
2、药品
氨NH3-氯化铵NH4Cl缓冲溶液[注1]
水样(可用自来水或泉水)
标准Na2H2edta[注2]
铬黑T指示剂(0.5%)[注3]
三乙醇胺N(CH2CH2OH)3(3%) 强酸型正离子交换树脂(001×7)
强碱型负离子交换树脂(201×7)
四、实验内容
1.水的总硬度测定
用移液管吸取100.00cm3水样[注4],置于250cm3锥形瓶中,首先加入5cm3三乙醇胺溶液[注5]和5cm3 NH3-NH4Cl缓冲溶夜[注6],摇匀后,加2~3滴铬黑T指示剂溶液,摇匀。用标准Na2H2edta溶液滴定至溶液颜色由紫红色变为蓝色[注7]。即达到滴定终点。记录所消耗的标准Na2H2edta溶液体积。再测下一次(按分析要求,两次滴定误差不应大于0.15cm3)。取两次数据的平均值,计算水样的总硬度(以mmol·dm-3或ppm表示之)。
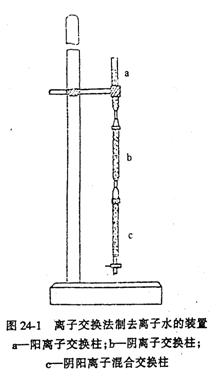
2.硬水软化——离子交换法(微型离子交换柱的制作)
(1)如图24-1取一支下端无磨口的交换柱,在底部垫上一些玻璃棉(或脱脂棉),装上5cm长的细乳胶管,再用螺旋夹夹紧。注入蒸馏水,以铁支架和试管夹垂直固定交换柱。取正负离子的混合交换树脂,置于5cm3井穴板中,加水浸泡过夜,使树脂溶胀。然后用一支口径稍大的玻璃滴管吸取树脂悬浊液,把树脂和水滴加到交换柱中。同时,放松螺旋夹使交换柱的水溶液缓缓流出,树脂即沉降到柱底。尽可能使树脂填装紧密,不留气泡。在装柱和实验过程中交换柱中液面应始终高于树脂柱面,树脂柱高8~10cm。
(2)阴离子交换树脂柱的准备
取强碱性阴离子交换树脂,以1mol·dm-3
NaOH溶液浸泡过夜使其转变为R-OH树脂。吸出上层清液后,以少量去离子水多次洗涤树脂至中性,然后按实验(1)的手法装入一支两端都有磨口的交换柱中,阴离子树脂柱高8cm,以去离子水洗至pH=7,备用。
(3)阳离子交换树脂柱的准备
微型阳离子交换树脂柱,也按实验(1)的办法装柱,经再生处理并用去离子水洗到中性后备用。
3.转型或再生
装入交换柱的树脂若是钠型树脂或是已经使用多次的树脂,则必须进行转型或再生处理,使树脂完全转变为氢型树脂,否则难以保证Ca2+完全交换出H+,而导致实验结果偏低。
转型的操作如下:用多用滴管吸取1mol·dm-3
HC1溶液,滴加30滴到交换柱中,松开螺旋夹,调节流出液以6~8滴/分种的速度流出。连续滴加HC1三次(共约90~100滴),待柱中HC1溶液液面降至接近树脂层表面时(不得低于表面!),滴加去离子水洗涤树脂,直到流出液呈中性(用pH试纸检验,约需130滴去离子水)。夹住螺旋夹,弃去流出液。(再生处理需用不含C1-的1mol·dm-3
HNO3代替HC1,其余操作同转型处理。)
4.水的净化[注3]
将上述三个微型离子交换柱按图24-1串联,就组成了离子交换法制去离子水的装置。柱间连接要紧密,不得有气泡。用多用滴管滴加自来水(用作原料水样),控制离子交换柱流速12滴/min,以干净的六孔井穴板承接流出液。当流出液充满2个穴后,第3、4个孔穴承接的流出水是1#水样,第5、6个孔穴承接的流出水是2#样品。
5.水的电导率的测定
用电导率仪分别测定1#~2#净化水样(在六孔井穴板中进行,用铂光亮电极)和自来水(3#水样,用铂黑电极)的电导率[注4]。
6.Ca2+、Mg2+的检验
分别取水样(或自来水),已经软化的水各约5cm3,各加入10滴铬黑T指示剂溶液,摇匀,观察并比较颜色。判断是否含有Ca2+和Mg2+。
五、实验前准备的思考题和预习要求
1.实验前准备的思考题
(1)用edta配合滴定法测定水硬度的基本原理是怎样的?使用什么指示剂?滴定终点的颜色变化如何?
(2)用离子交换法使硬水软化和净化的基本原理是怎样的?操作中有哪些应注意之处。
(3)为什么通常可用电导率值的大小来估计水质的纯度?是否可以认为电导率值越小,水质的纯度越高?
2.预习要求
(1)理解离子交换法软化,净化水的原理及操作注意事项。
(2)预习精密仪器十二(电导率仪)和基本操作(容量瓶、滴定管和移液管的洗涤和使用)。
[注1]称取67.5gNH4Cl晶体溶于少量去离子水中,加入570cm3浓氨水,然后再加入1g Na2Mgedta·2H2O晶体后,稀释至1dm3。
[注2]将Na2Mgedta·2H2O置于80℃烘箱中干燥2h,冷却后,准确称取3.7g(4位有效数字)溶于适量去离子水,然后移至1dm3容量中,稀释至刻度,摇匀(需长期放置时,应贮存于聚乙烯瓶中,并定期核对其浓度)。
标定标准Na2Mgedta溶液 量取25.00cm3标准钙离子溶液置于25cm3锥形瓶中,然后加入5cm3缓冲溶液,摇匀后,加入量铬黑T指示剂,用标准Na2Mgedta溶液进行滴定,溶液由紫红色刚转为蓝色时即为终点。按下式可算出标准Na2Mgedta溶液的精确浓度。
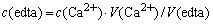
式中:c(Ca2+)——标准钙离子溶液的浓度(mol·dm-3);
V(Ca2+)——所取标准钙郭溶液的体积(cm3);
V(edta)——滴定中所消耗的Na2Mgedta溶液的体积(cm3)。
附:标准钙离子溶液(0.01mol·dm-3,4位有效数字)的配制,将基准CaCO3(分析试剂)置于110℃烘箱中干燥约2h,冷却后,准确称取0.5~0.6g(4位有效数字)并溶解之。然后逐滴加入2 mol·dm-3
HCl溶液(此时可用一表面皿遮盖烧杯,以防固体溅失)至CaCO3完全溶解。再小心加热至沸,待冷却后转入500cm3容量瓶中,稀释到刻度。
[注3]称取4.5g盐酸羟胺溶于18cm3去离子水中,另有研钵中加0.5g铬黑T研细。两者混合后,用质量分数95%乙醇定容至100cm3。贮存于棕色滴瓶中备用,使用期不应超过一个月。
[注4]此量一般适用于总硬度0.018~4.5m mol·dm-3的水样。若总硬度大于4.5m mol·dm-3,则水样取量要相应减少。若水样不澄清,则必须过滤之。过滤所用的仪器和定性滤纸必须干燥,最初和最后的滤液宜弃去。若水样的酸性或碱性过高,则可用NaOH溶液HCl溶液中和后,再加缓冲溶液。本实验可取自来水或泉水作为待测水样。
[注5] edta还能与其他金属离子如Fe3+、Cu2+、Zn2+和Mn2+等配合,当水样中含有上述离子时将影响滴定结果。对Cu2+、Al3+等离子,一般可藉加入三乙醇胺进行掩盖(也可以适量氰化物进行消除)。对Cu2+、Zn2+、Mn2+等离子一般可加适量的KCN或Na2S溶液进行掩盖或除去,以消除干扰。
[注6]水样中Ca(HCO3)2、Mg(HCO3)2含量较高时,在NH3-NH4Cl溶液中会慢慢析出的是CaCO3和[Mg(OH)2]2CO3沉淀,从而影响滴定终点的观察,变色不敏锐。遇此情况,水样可适量盐酸酸化,煮沸2~3min,去除CO2后,再进行测定。
[注7]在NH3-NH4Cl缓冲溶液(pH≈10)中,edta与Ca2+、Mg2+所形成的配离子最稳定,且铬黑T指示剂显蓝色。Edta与Ca2+、Mg2+配合的反应速度较慢(必要时,可将水样加热至30~40℃再进行滴定),所以接近终点时,应特别慢地滴入,同时要不断那里烈摇荡锥形瓶,否则会因反应未完全,而造成Na2Mgedta溶液过量的情况。
[注8]流速不宜过快,否则要影响树脂的交换质量。
[注9]净化水的电导率测定应尽快进行。否则空气中的少量CO2、HCl、NH3等气体将溶入水中,会使水的电导率值升高,引起实验误差。
六、参考文献
浙江大学普通化学教研组,《普通化学实验》,高等教育出版,1997年。
|